- Réaction de Vilsmeier-Haack
-
 Pour les articles homonymes, voir Haack.
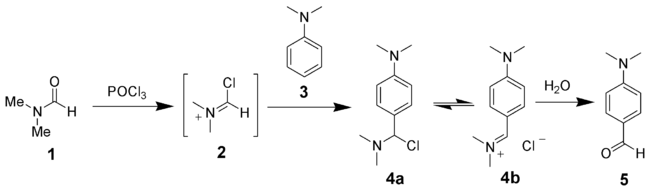
Pour les articles homonymes, voir Haack.La réaction de Vilsmeier-Haack (aussi appelée réaction de Vilsmeier) est une réaction chimique entre un amide substitué (1), le trichlorure de phosphoryle et un dérivé benzénique riche en électron (3) pour produire un benzaldéhyde ou une phénone (5). Cette réaction est nommée d'après Anton Vilsmeier et Albrecht Haack[1],[2],[3].
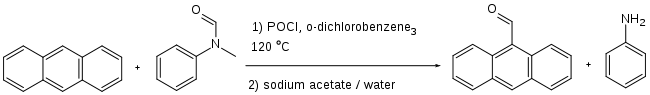
Par exemple, le benzanilide et le diméthylaniline réagissent avec le trichlorure de phosphoryle pour produire une diaryl cétone asymétrique[4]. De façon similaire, l'anthracène peut être formylé, mais exclusivement en position 9[5]:
Sommaire
Mécanisme réactionnel
Dans un premier temps, l'amide substitué s'additionne sur le trichlorure de phosphoryle, qui libère alors un ion chlorure. Cet ion chlorure vine se substituer sur le carbone porteur de l'ancien groupe carbonyle, produisant un ion chloroiminiumsubstitué (2 dans le premier schéma), appelé aussi réactif de Vilsmeier. Ce composé est un électrophile, en particulier sur le carbone du groupe iminium, aussi lié au chlore. En présence d'un dérivé benzénique, riche en électron, il se produit donc naturellement une substitution électrophile aromatique
Le produit de cette substitution (4a), une amine chlorée se réorganise par élimination d'un ion chlorure en ion iminium (4b), qui est ensuite hydrolysé en cétone ou aldéhyde aromatique correspondant (5)[6].

Applications
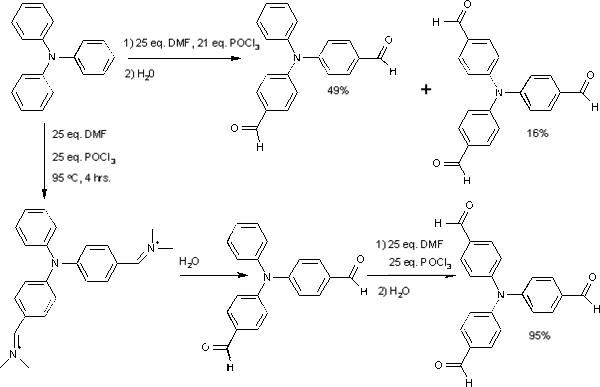
Une récente application de cette réaction est une nouvelle voie de synthèse de la tris(4-formylphényl)amine[7] à partir de la triphénylamine, qui par les méthodes jusque là utilisée n'avait qu'un modeste rendement de 16%. Il a été montré que ce faible taux résultait de la désactivation du cycle benzénique par les groupes imines des deux autres groupes phényls lors de la troisième formylation. La procédure a donc été modifiée pour former une di-imine suivie d'un hydrolyse pour former le di-formyl correspondant. Enfin, avec la position finale réactivée, il est pratiqué la dernière formylation, toute seule, et former le composé tri-substitué avec un rendement de l'ordre de 95%.
Notes et références
- Anton Vilsmeier; Haack, A. Ber. 1927, 60, 119.
- Meth-Cohn, O.; Stanforth, S. P. Comp. Org. Syn. 1991, 2, 777-794. (Review)
- Formylation of dimethylaniline. Campaigne, E.; Archer, W. L. Org. Syn., Coll. Vol. 4, p. 331 (1963); Vol. 33, p. 27 (1953). (Article)
- Vilsmeyer-Haack reaction of benzanilide and dimethylaniline. Hurd, C. D.; Webb. C. N. Org. Syn., Coll. Vol. 1, p. 217 (1941); Vol. 7, p. 24 (1927). (Article)
- Formylation of anthracene. Fieser, F. L.; Hartwell, J. L.; Jones, J. E.; Wood, J. H.; Bost, R. W. Org. Syn., Coll. Vol. 3, p. 98 (1955); Vol. 20, p. 11 (1940). (Article)
- Jones, G.; Stanforth, S. P. Org. React. 2000, 56, 355. (doi: 10.1002/0471264180.or056.02)
- Practical and Efficient Synthesis of Tris(4-formylphenyl)amine, a Key Building Block in Materials Chemistry Thomas Mallegol, Said Gmouh, Mohamed Aït Amer Meziane, Mireille Blanchard-Desce, Olivier Mongin Synthesis 2005, 1771-1774. (DOI:10.1055/s-2005-865336)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Vilsmeier–Haack reaction » (voir la liste des auteurs)
Voir aussi
Wikimedia Foundation. 2010.