- C6H5COOH
-
Acide benzoïque
Acide benzoïque 
Général Nom IUPAC acide benzoïque Synonymes Acide benzènecarboxylique No CAS No EINECS No E E210 FEMA Apparence cristaux blancs ou poudre.[1] Propriétés chimiques Formule brute C7H6O2 [Isomères] Masse molaire 122,1213 g∙mol-1
C 68,85 %, H 4,95 %, O 26,2 %,pKa 4,2 Propriétés physiques T° fusion 122 °C[1] T° ébullition 249 °C[1] Solubilité dans l'eau à 20 °C : 0.29 g/100 ml[1],
Bonne dans le chloroforme, l'éthanol et l'acétoneMasse volumique (eau = 1) : 1.3[1] T° d’auto-inflammation 570 °C[1] Point d’éclair 121 °C c.f.[1] Pression de vapeur saturante à 25 °C : 0.1 Pa[1] Thermochimie S0solide 165,7 J/mol·K sous 1 bar ΔfH0solide 384,8 kJ/mol Cp 148 J/mol.K à 300 K
259 J/mol·K à 413 K (liquide)Précautions Directive 67/548/EEC 
XnPhrases R : 22, 36, Phrases S : 24, NFPA 704 SIMDUT[2] 
Écotoxicologie DL50 1700 mg/kg (rats, peroral) LogP 1.87[1] Unités du SI & CNTP, sauf indication contraire. L'acide benzoïque, de formule chimique C6H5COOH (ou C7H6O2) est un acide carboxylique aromatique dérivé du benzène.
Sommaire
Description
Il est utilisé comme conservateur alimentaire et est naturellement présent dans certaines plantes. C'est par exemple l'un des principaux constituants de la gomme benjoin, utilisée dans des encens dans les églises de Russie et d'autres communautés orthodoxes. Bien qu'étant un acide faible, l'acide benzoïque n'est que peu soluble dans l'eau du fait de la présence du cycle benzénique apolaire.
Parmi les principaux composés qui dérivent de l'acide benzoïque, on peut citer l'acide salicylique et l'acide acétylsalicylique plus connu sous le nom d'aspirine.
En tant qu'additif alimentaire, il est référencé en Europe sous le code E210. Ses sels, que l'on appelle des benzoates, sont référencés sous les numéros :
- E211 Benzoate de sodium (Ba)
- E212 Benzoate de potassium (Ba)
- E213 Benzoate de calcium (Ba)
Il est considéré comme un additif cancérigène. Au-dessus de 370 °C, il se décompose en formant du benzène et du dioxyde de carbone. L'acide benzoïque a une odeur forte et est facilement inflammable.
Historique
En 1830, Wöhler rencontre Justus von Liebig, qui poursuit des recherches similaires sur les cyanates. Ils extraient, en 1837, l’amygdaline à partir des amandes amères, et découvrent l’acide benzoïque en oxydant l’amygdaline par l’acide nitrique. En 1832, ils publient les résultats de travaux et montrent que les radicaux organiques peuvent se combiner à l’hydrogène électropositif aussi bien qu’à l’oxygène électronégatif. Ils éditent ensemble les Annalen der Chemie und Pharmazie .
Production
Production industrielle
L'acide benzoïque est produit industriellement par oxydation partielle du toluène par l'oxygène en phase gazeuse en présence de catalyseurs tels que, par exemple, le pentoxyde de vanadium (V2O5).
Synthèse au laboratoire
L'acide benzoïque est peu cher et disponible auprès de nombreux fournisseurs. Sa synthèse au laboratoire est seulement pratiquée à titre d'exercices pédagogiques.
- L'oxydation du toluène, de l'alcool benzylique ou de la benzaldéhyde par le permanganate de potassium produit aussi de l'acide benzoïque.
- On peut l'obtenir par l'hydrolyse d'un composé de même niveau d'oxydation que lui (par exemple à partir du benzonitrile ou du benzamide).
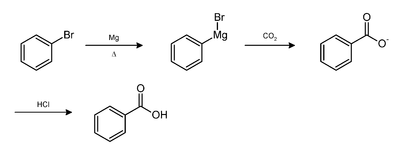
- On peut aussi l'obtenir par combinaison d'un organomagnésien. Le schéma réactionnel ci-dessous montre par exemple l'obtention de l'acide benzoïque à partir du bromobenzène.
Précautions
- Phrases de risque :
- R22 (Nocif en cas d’ingestion)
- R36 (Irritant pour les yeux)
- Conseils de prudence :
- S24 (Éviter le contact avec la peau)
Risques
Selon une étude britannique publiée en 2007, l'acide benzoïque favorise l'hyperactivité infantile, plus précisément le trouble du déficit de l'attention[3].
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est inscrite à l’annexe I de la directive 91/414/CEE par la directive 2004/30/CE.
- pour la France : cette substance active est autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché.
Voir aussi
- Benzoate de sodium
- Liste des acides
- PTBBA(4-tert-Butylbenzoic acid)
Liens externes
Références
- ↑ a , b , c , d , e , f , g , h et i ACIDE BENZOIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide benzoïque » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Jim Stevenson et alli, université de Southampton, in The Lancet, septembre 2007. Etude relatée dans Le Monde, 7 septembre 2007.
- Portail de la chimie
Catégories : Produit chimique nocif | Composé aromatique | Acide carboxylique
Wikimedia Foundation. 2010.