- C10H16N2O8
-
EDTA
EDTA 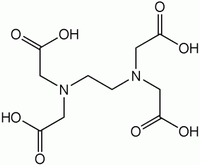
Général Nom IUPAC acide éthylène-
diamine-tétraacétiqueSynonymes Acide édétique[1] No CAS No EINECS No E E385 (Ca, Na)
E386 (Na)SMILES InChI Apparence solide incolore à blanc, inodore [2] Propriétés chimiques Formule brute C10H16N2O8 [Isomères] Masse molaire 292,2426 g∙mol-1
C 41,1 %, H 5,52 %, N 9,59 %, O 43,8 %,Propriétés physiques T° fusion 245 °C (décomposition) [3] Solubilité 1 g/L (eau, 25 °C) [3]
400 mg/l (eau, 20 °C) [2]Masse volumique 0,86 g/cm³ (20 °C) [2] T° d’auto-inflammation > 200 °C [2] Point d’éclair > 100 °C [2] Pression de vapeur saturante < 0,013 mbar (20 °C) [2] Précautions Directive 67/548/EEC 
XiPhrases R : 36, Phrases S : 2, 26, [4] SIMDUT[5] 
Écotoxicologie DL50 30mg/kg (souris, oral)
28.5mg/kg (souris, i.v.)
250mg/kg (souris, i.p.) [3]Unités du SI & CNTP, sauf indication contraire. L'EDTA est le sigle de l'acide éthylène diamine tetra acétique. La formule chimique de cet acide diaminotétracarboxylique est C10H16N2O8 de masse molaire 292,24264 g mol-1.
L'EDTA comporte 6 acidités, 4 correspondant aux fonctions carboxyliques (acides de Bronsted) et 2 correspondant aux fonctions amines (acides de Lewis)
Sa principale caractéristique est son fort pouvoir chélatant (ou complexant) par lequel il forme des complexes métalliques très stables, ce qui en fait un poison. Dans les complexes, l'EDTA est lié aux cations métalliques sous la forme d'une de ses bases conjuguées.
Applications
Il est susceptible d'être utilisé dans de nombreuses applications, par exemple dans l'industrie du papier, la photographie ou les industries de l'hygiène et l'alimentaire (antioxygène, agent de conservation et séquestrant E385[6]). En raison de sa toxicité, la concentration est évidemment adaptée à l'usage. L'EDTA est utilisé pour traiter des eaux (par exemple dans les lessives), pour éviter les précipitations (entartrage).
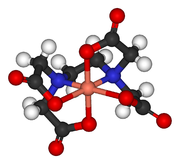 Complexe de Cu2+ de l'EDTA
Complexe de Cu2+ de l'EDTA
- En chimie, l'EDTA est utilisé pour doser par complexation les ions métalliques en solution (TH).
- En biochimie, l'EDTA est utilisé comme inhibiteur des métallo-enzymes. Son utilisation est très fréquente dans la purification des acides nucléiques (ADN ou ARN) et des protéines (voir tampon TAE et tampon TBE). En séquestrant en particulier les ions magnésium Mg2+, il bloque l'activité de nombreuses nucléases qui sont dépendantes de cet ion. L'EDTA est également un inhibiteur des métalloprotéases à zinc et limite ainsi l'hydrolyse des protéines dans les extraits cellulaires. En génie biologique, l'EDTA est utilisé en routine pour stopper l'activité de polymérases, la chélation des ions Calcium modifiant la conformation des enzymes.
- En médecine, l'EDTA, en formant des chélates ferriques (du fer(III)), permet de lutter contre les surcharges tissulaires en fer (hypersidéroses). L'EDTA est utilisé aussi dans les intoxications par métaux lourds. Il est également utilisé comme conservateur dans les collyres, en conjonction avec d'autres conservateurs tels que le thiomersal ou le chlorure de benzalkonium [7]. L'EDTA est aussi utilisé comme anticoagulant.
- En agronomie, l'EDTA est un chélateur capable de faire rentrer certains éléments nutritifs dans la plante. Un ajout d'EDTA dans un sol permet de lutter contre les carences en oligo-éléments.
- Dans le domaine de l'agroalimentaire et de la cosmétique, l'EDTA est utilisé comme stabilisateur de produit vis-à-vis de la dégradation par les bactéries (fermentation). Comme les complexes métalliques de l'EDTA sont nettement plus stables que ceux dérivés de ligands protéiques, les cations métalliques deviennent indisponibles pour les micro-organismes pour lesquels ils sont essentiels, d'où une inhibition de la croissance bactérienne.
- Dans le domaine médical et paramédical, un prélèvement sanguin sur tube EDTA correspond à prélèvement sur un tube à bouchon violet.
Voir aussi
- EGTA
- BAPTA
Références
- ↑ ACIDE EDETIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e et f Entrée du numéro CAS « 60-00-4 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 février 2009 (JavaScript nécessaire)
- ↑ a , b et c (en) « Edetic acid » sur ChemIDplus, consulté le 13 février 2009
- ↑ « acide edetique » sur ESIS, consulté le 13 février 2009
- ↑ « Acide éthylènediaminetétraacétique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ [pdf] Codex Alimentarius (1989)Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35.
- ↑ Drs. Patrice Vo Tan & Yves Lachkar, Les conservateurs en ophtalmologie, Librairie Médicale Théa
- Portail de la biochimie
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie
Catégories : Produit chimique irritant | Sigle de 4 caractères | Acide aminé | Polyamine | Agent conservateur | Agent chélatant | Séquestrant | Antidote
Wikimedia Foundation. 2010.
