- Phosphofructokinase-1
-
Phosphofructokinase-1 
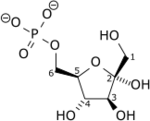
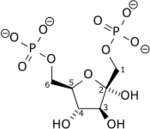
N° EC EC N° CAS Bases de données IntEnz Vue IntEnz BRENDA Entrée BRENDA IUBMB 2.7.1.11 à l'IUBMB KEGG Entrée KEGG MetaCyc Voie métabolique PRIAM Profil PDB Structures GO AmiGO / EGO La phosphofructokinase-1 (PFK-1) est une enzyme intervenant dans la 3e étape de la glycolyse pour catalyser la conversion du fructose-6-phosphate en fructose-1,6-diphosphate :
Le β-D-fructose-6-phosphate (Fru-6-P) produit au cours de la glycolyse est phosphorylé en β-D-fructose-1,6-diphosphate (Fru-1,6-DP) par la phosphofructokinase-1 à partir d'une molécule d'ATP, hydrolysée en ADP + Pi. Cette consommation d'énergie rend cette étape irréversible, et constitue un point de régulation majeur de la vitesse de la glycolyse. Un cation Mg2+ intervient comme cofacteur.
Son activité est régulée de façon allostérique, c'est-à-dire que la PFK-1 change de forme (et donc d'activité) selon les molécules liées à elle. Elle est inhibée par le NADH + H+, le FAD, l'ATP, l'acide citrique, qui sont des marqueurs de charge énergétique élevée ; elle est en revanche activée par la phosphofructokinase-2 (PFK-2), elle-même activée par le glucagon, via la synthèse de fructose-2,6-diphosphate.
Elle est impliquée dans la régulation du métabolisme glucidique conjointement avec la fructose diphosphatase (EC ).
Il existe, essentiellement chez des organismes autres que les animaux, des enzymes différentes capables de phosphoryler le Fru-6-P à partir de pyrophosphate inorganique au lieu d'ATP. C'est le cas de la diphosphate fructose-6-phosphate 1-phosphotransférase (PFP), qu'on trouve chez de nombreux végétaux, certaines bactéries, des archées et des protistes. De rares archées possèdent une variante de la phosphofructokinase utilisant, cette fois, de l'ADP et non de l'ATP.
Article connexe
Wikimedia Foundation. 2010.