- Phosphofructokinase-2
-
Phosphofructokinase-2 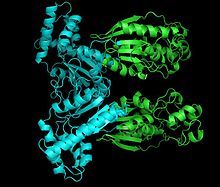
Structure de la 6-phosphofructo-2-kinase :
à droite, le domaine phosphatase ;
à gauche, le domaine kinase.N° EC EC N° CAS Bases de données IntEnz Vue IntEnz BRENDA Entrée BRENDA IUBMB 2.7.1.105 à l'IUBMB KEGG Entrée KEGG MetaCyc Voie métabolique PRIAM Profil PDB Structures GO AmiGO / EGO La phosphofructokinase-2 (PFK-2) ou fructose-diphosphatase-2 (FDPase-2) est une enzyme intervenant dans la régulation de l'activité de la phosphofructokinase-1, laquelle intervient dans la 3e étape de la glycolyse pour catalyser la conversion du fructose-6-phosphate en fructose-1,6-diphosphate.
Fonction
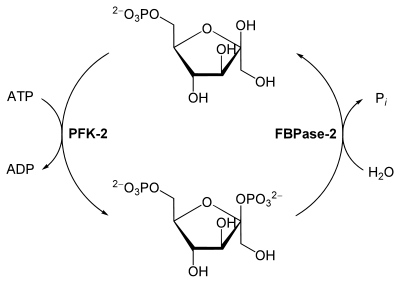
La PFK-2/FDPase-2 possède une double activité enzymatique antagoniste, à savoir une activité kinase catalysant la phosphorylation du D-fructose-6-phosphate (Fru-6-P) en D-fructose-2,6-diphosphate (Fru-2,6-DP) par l'ATP, et une activité phosphatase catalysant l'hydrolyse du Fru-2,6-DP en Fru-6-P et Pi :
Le D-fructose-2,6-diphosphate est un activateur allostérique de la phosphofructokinase-1 (PFK-1), ce qui a pour effet de stimuler la glycolyse et de faire chuter le taux de glucose dans le cytoplasme.
Structure et régulation
La PFK-2/FDPase-2 est un homodimère de deux sous-unités de 55 kDa chacune arrangées en tête-à-tête pour former d'un côté un domaine phosphatase et de l'autre un domaine kinase, ce dernier du côté N-terminal des deux chaînes polypeptidiques. La sérine-32 de ces chaînes peut être phosphorylée, ce qui modifie la conformation de la protéine favorisant l'activité phosphatase FDPase-2 ; lorsque la Ser-32 n'est pas phosphorylée, c'est au contraire l'activité kinase PFK-2 qui est favorisée.
- La phosphorylation de la sérine-32 est catalysée par la protéine kinase A, activée par l'AMPc, elle-même produite comme second messager par l'adénylcyclase sous l'effet du glucagon, qui a donc indirectement pour effet d'arrêter la glycolyse en favorisant la formation de D-fructose-6-phosphate à partir du D-fructose-2,6-diphosphate, dont la concentration diminue, ce qui bloque la phosphofructokinase-1.
- L'enzyme est au contraire déphosphorylée sous l'effet de la protéine-phosphatase-1 (PP1), elle-même activée par le D-fructose-6-phosphate, dont le taux augmente en même temps que celui du glucose : l'activité kinase PFK-2 convertit le D-fructose-6-phosphate en D-fructose-2,6-diphosphate, ce qui réactive la phosphofructokinase-1, et donc la glycolyse.
Wikimedia Foundation. 2010.