- Réarrangement de Baeyer-Villiger
-
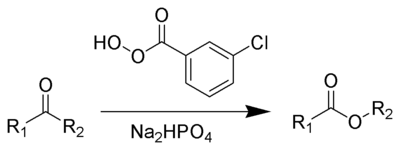
Le réarrangement de Baeyer-Villiger ou oxydation de Baeyer-Villiger est une réaction de réarrangement utilisée en chimie organique dans laquelle une cétone est oxydée en ester par réaction avec un peracide ou avec l'eau oxygénée[1],[2]. La réaction est stéréospécifique et régiosélective[3]. Elle doit son nom au chimiste allemand Adolf von Baeyer et au chimiste suisse Victor Villiger.
On utilise typiquement comme réactifs l'acide méta-chloroperbenzoïque, l'acide peroxyacétique, ou l'acide peroxytrifluoroacétique[4]. Les cétone réactives ou cycliques à cycle tendu (cyclobutanones, norbornanones) réagissent avec le peroxyde d'hydrogène ou des hydroperoxydes pour former des lactones. Le réactif original utilisé pour la publication de 1899 est l'acide de Caro, découvert un an auparavant[5]. De l'hydrogénophosphate de sodium ou du bicarbonate de sodium est souvent ajouté comme agent tampon pour empêcher une transestérification ou une hydrolyse.
Sommaire
Mécanisme réactionnel
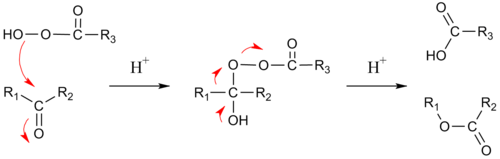
Le mécanisme réactionnel du clivage oxydatif implique une première addition de peroxyacide au carbonyle formant un intermédiaire tétrahédrique appelé aussi intermédiaire de Criegee pour sa similarité avec l'intermédiaire réactionnel du réarrangement du même nom. L'état de transition de cette étape est vu comme un relai hydrogène impliquant trois molécules de peroxyacide avec des interactions linéaires O-H-O[6]. Puis, il y a migration concertée de l'un des carbones adjacents sur l'oxygène, avec la perte d'un acide carboxylique. Si le carbone migrant est chiral, son orientation est maintenue.
- Aptitude migratoire[7] : H > alkyle tertiaire > cyclohexyle > alkyle secondaire, aryle > alkyle primaire > méthyle
Dans l'état de transition de la phase de migration, l'angle dihédrique du R-C-O-O doit être de 180° afin de maximiser l'interaction entre la liaison sigma R-C pleine et la liaison sigma anti-liante O-O. Cetté étape est aussi (du moins in silico) assistée par deux ou trois unités de peroxyacide permettant au proton hydroxyle de trnasiter vers sa nouvelle position[6].
Pour les cétones asymétriques, le groupe migrant est généralement celui que stabilise le mieux sa charge positive. Ainsi, les cétones cycliques produisent par cette réaction des lactones et les aldéhydes des acides carboxyliques, même si des formiates peuvent être aussi formé si le groupe migrant est tertiaire ou est un groupe riche en électron, comme un groupe viyle ou un cycle aromatique (réaction de Dakin). Parfois, un alcool (chimie) est formé si le formate est hydrolytiquement instable.
Oxydation biocatalytique
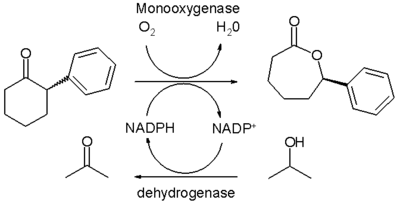
L'oxydation de Baeyer-Villiger peut aussi être effectuée sous biocatalyse, utilisant une enzyme appelée Baeyer-Villiger monooxygénase ou BVMO. Bien que largement expérimentale, cette technique semble pleine de promesse concernant l'énantiosélectivité et son potentiel dans le cadre de la chimie verte.
Notes et références
- A. Baeyer, « Einwirkung des Caro'schen Reagens auf Ketone », dans Ber., vol. 32, no 3, 1899, p. 3625–3633 [texte intégral [abstract], lien DOI]
- A. Baeyer, « Ueber die Einwirkung des Caro'schen Reagens auf Ketone », dans Ber., vol. 33, no 1, 1900, p. 858–864 [texte intégral [abstract], lien DOI]
- Crudden, C. M.; Chen, A. C.; Calhoun, L. A., « A Demonstration of the Primary Stereoelectronic Effect in the Baeyer-Villiger Oxidation of α-Fluorocyclohexanones », dans Angew. Chem. Int. Ed., vol. 39, no 16, 2000, p. 2851–2855 [lien DOI]
- Burton, J.W.; Clark, J.S.; Derrer, S.; Stork, T.C.; Bendall, J.G.; Holmes, A.B., « Synthesis of Medium Ring Ethers. 5. The Synthesis of (+)-Laurencin », dans J. Am. Chem. Soc., vol. 119, no 32, 1997, p. 7483–7498 [texte intégral [Abstract], lien DOI]
- Michael Renz, Bernard Meunier, « 100 Years of Baeyer-Villiger Oxidations », dans European Journal of Organic Chemistry, vol. 1999, no 4, 1999, p. 737–750 [lien DOI]
- The Role of Hydrogen Bonds in Baeyer-Villiger Reactions Shinichi Yamabe and Shoko Yamazaki J. Org. Chem.; 2007; 72(8) pp 3031 - 3041; (Article) DOI:10.1021/jo0626562
- ( « > » signifie « migre plus facilement que » )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Baeyer–Villiger oxidation » (voir la liste des auteurs)
Voir aussi
Wikimedia Foundation. 2010.