- Hydroperoxyde
-
Un hydroperoxyde est un composé chimique contenant le groupe fonctionnel hydroperoxyle H-O-O-. Il s'agit d'un peroxyde particulier dont un des oxygènes est lié avec un atome d'hydrogène lui conférant ainsi une fonction acide. Les hydroperoxydes se classent généralement dans 2 classes: les alkylhydroperoxydes organique et les hydroperoxydes organominéraux.
Sommaire
Propriétés physico-chimiques
La plupart de alkylhydroperoxydes sont liquides ou solides.
La solubilité dans l'eau et la propension à exploser diminuent avec l'augmentation de la masse moléculaire suite à la diminution de l'influence de l'oxygène. C'est pour cette raison que la formation d'hydroperoxydes est évitée notamment lors du stokage des éther-oxydes qui doivent être conservés à l'abri de l'air et de la lumière. L'acidité de ces composés est plus grande que celle des alcools[1] et en solution ils forment l'ion hydroperoxyde R-O-O-. Leurs sels ne peuvent en général pas être isolés. L'énergie de la liaison oxygène-oxygène est de l'ordre de 167-184 kJ·mol-1 et celle de la liaison oxygène-hydrogène est de 375 kJ·mol-1[1].
Les hydroperoxydes peuvent réagir par et sans clivage de la liaison oxygène-oxygène. Ces composés réagissent avec de nombreux autres substances pour former des peroxydes organiques. L'hydroperoxyde d'origine est dès lors réduit en alcool. Ces réactions sont quantitatives et souvent utilisées en chimie analytique[1].
Les bases réagissent pour former des cétones ou des aldéhydes. Toutefois, la réaction entre les bases et les hydroperoxydes est lente. Les acides réagissent de 2 manières: soit par l'élimination de la fonction hydroperoxxyle et la formation de peroxyde d'hydrogène soit par scission de la liaison oxygène-oxygène et la formation d'un alcool et d'un composé carbonylé[1].
Les hydroperoxydes sont sensibles à la lumière et à la chaleur qui conduisent à une clivage homolytique de la liaison oxygène-oxygène. Ils également sensibles à l'action des radicaux.
Synthèse
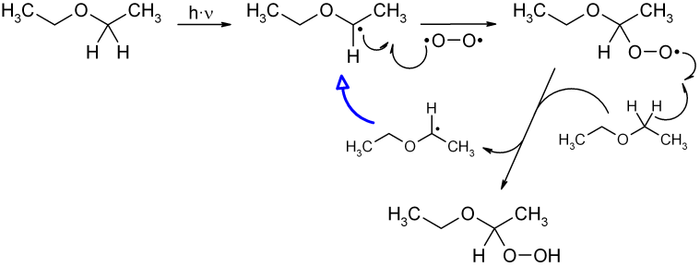
La formation d'hydropéroxydes est généralement observée lors de réactions d'autoxydation, c'est-à-dire de réaction de composés organiques avec le dioxygène de l'air, ou par réaction d'organométalliques (organomagnésiens par exemple) avec le dioxygène.
Le schéma ci-dessus montre le mécanisme menant à la formation de l'« éther péroxyde » (péroxyde de diéthyléther), par réaction du diéthyléther (éthoxyéthane) avec le dioxygène de l'air. La réaction débute par l'irradiation lumineuse de l'éther diéthylique qui forme alors un radical qui réagit ensuite avec le dioxygène. La molécule formée réagit alors avec une autre molécule d'éther, formant le péroxyde de diéthyléther et un nouveau radical de diéthyléther, permettant ainsi à la réaction de se poursuivre tant qu'une molécule de dioxygène est présente.
Utilisations
Le tert-butylhydroperoxyde est utilisé en synthèse pour les réactions d'époxydation, en particulier pour l'époxydation de Sharpless.
Notes et références
- (en) Jose Sanchez and Terry N. Myers, Peroxides and Peroxide Compounds, Organic Peroxides, Wiley-VCH Verlag GmbH & Co, coll. « Kirk‑Othmer Encyclopedia of Chemical Technology », 4 décembre 2000
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Hydroperoxide » (voir la liste des auteurs)
Wikimedia Foundation. 2010.