- Sulfure de potassium
-
Sulfure de potassium 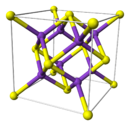
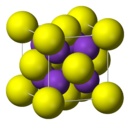
atome de soufre (en jaune) et de potassium (en violet)Général Nom IUPAC sulfure de potassium Synonymes monosulfure de dipotassium
sulfure de dipotassium
monosulfure de potassiumNo CAS No EINECS No RTECS Code ATC InChI Apparence incolore pur
impur jaune-marronPropriétés chimiques Formule brute K2S [Isomères] Masse molaire[1] 110,262 ± 0,005 g·mol-1
K 70,92 %, S 29,08 %,Propriétés physiques T° fusion 840 °C T° ébullition déc. Solubilité réaction avec l'eau → KSH + KOH
soluble dans l'éthanol, le glycérolMasse volumique 1,81 g·cm-3 Cristallographie Structure type antifluorite Précautions Directive 67/548/EEC[2] 
C
NPhrases R : 31, 34, 50, Phrases S : 26, 45, 61, Unités du SI & CNTP, sauf indication contraire. Le sulfure de potassium est le composé inorganique de formule brute K2S. Ce solide incolore n'est que très rarement rencontré naturellement car il réagit facilement et de manière irréversible avec l'eau en formant de l'hydrogénosulfure de potassium (KSH) et de l'hydroxyde de potassium (KOH).
Sommaire
Structure
Le sulfure de potassium adopte une structure antifluorite ce qui signifie que les petits ions K+ occupent les sites tétraédriques des anions F– dans la fluorine et les centres S2–, plus gros, occupent les sites de coordination 8 des Ca2+. Li2S, Na2S et Rb2S cristallisent de la même façon[3].
Synthèse et réactions
K2S provient de la réaction du potassium et du soufre. En laboratoire, cette synthèse est généralement menée en combinant une solution de potassium dans l'ammoniac anhydre avec du soufre élémentaire.
Il peut également être produit par chauffage du sulfate de potassium, K2SO4 avec du charbon:
- K2SO4 + 2C → K2S + 2 CO2
- K2SO4 + 4C → K2S + 4 CO
Ce sel contient des anions S2− qui sont très basiques et qui s'hydrolysent complétement selon l'équation suivante :
- K2S + H2O → KOH + KSH
Pour de nombreuses raisons, cette réaction est sans conséquence puisque le mélange des ions SH– et OH– se comporte comme une source de S2–. Les autres sulfures de métal alcalin se comportent de façon similaire[3].
Utilisation dans les feux d'artifice
Du sulfure de potassium se forme lorsque de la poudre noire est brûlée. Il est un intermédiaire important dans de nombreux effets pyrotechniques, tels que le Senko Hanabi et certaines formulations de paillettes[4].
Utilisation en Bijouterie
Il peut donner toutes sortes de teintes à l'argent (orange, rouge, bleu..)
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Potassium sulfide » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- http://ecb.jrc.ec.europa.eu/esis/index.php?LANG=de&GENRE=CASNO&ENTREE=1312-73-8
- Holleman, A. F.; Wiberg, E.; "Inorganic Chemistry" Academic Press: San Diego, 2001. (ISBN 0-12-352651-5).
- Shimizu, Takeo. "Fireworks: the Art, Science, and Technique." Pyrotechnica Publications : Austin, 1981. (ISBN 0-929388-05-4).
