- Sulfate de potassium
-
Sulfate de potassium 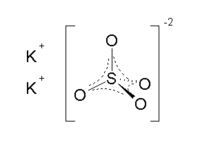
Général Synonymes Dipotassium sulfate No CAS No EINECS PubChem No E E515 SMILES InChI Apparence cristaux incolores a blancs[1]. Propriétés chimiques Formule brute K2SO4 Masse molaire[2] 174,259 ± 0,006 g·mol-1
K 44,87 %, O 36,73 %, S 18,4 %,Propriétés physiques T° fusion 1 067 °C[1] T° ébullition 1 689 °C[1] Solubilité dans l'eau à 25 °C : 120 g·l-1[1] Masse volumique 2,66 g·cm-3[1] Cristallographie Système cristallin orthorhombique Précautions SIMDUT[3] Produit non contrôlé Composés apparentés Anions apparentés sulfate de lithium, sulfate de sodium, sulfate de cuivre Unités du SI & CNTP, sauf indication contraire. Le sulfate de potassium est un composé chimique courant formé d'un ion sulfate et de deux ions potassium. C'est un sel solide cristallin blanc de formule chimique K2SO4, soluble dans l'eau. Il est utilisé principalement comme engrais et marginalement comme additif alimentaire (régulateur d'acidité E515)[4].
Le potassium dans la plante
Le potassium constitue une grande partie des matières minérales des plantes qui l'assimilent sous la forme d'ions K+ en solution dans l'eau (mais aussi dans le sol, mais avec une très nette préférence pour celui dissout dans l'eau). Il n'a pas un rôle plastique, mais joue un rôle dans la régulation de la croissance végétale (c'est pour cette raison que l'analyse révèle une présence de potassium plus élevée dans les tissus jeunes que dans les tissus âgés). À ce rôle de régulateur, on peut ajouter une autre fonction qui pourrait se comparer à celle de transporteur. Il intervient en effet dans la photosynthèse, car il favorise la synthèse, la migration et l'accumulation des acides aminés dans les organes. Sans la présence de potassium, la plante ne peut utiliser correctement l'azote. La plante absorbe facilement le potassium : il faut éviter l'excès de cet élément car l'antagonisme existant entre le potassium et le magnésium peut bloquer l'assimilation de cet élément et induire une carence en magnésium.
Notes et références
- SULFATE DE POTASSIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Sulfate de potassium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Noms de catégorie et système international de numérotation des additifs alimentaires - Codex Alimentarius
