- Butane-1,3-diol
-
Butane-1,3-diol 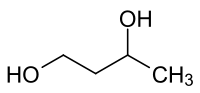
Général Nom IUPAC butane-1,3-diol Synonymes 1,3 butylène glycol
1,3-dihydroxybutaneNo CAS (mélange racémique)
(R)
(S)-(+)No EINECS PubChem SMILES InChI Apparence liquide visqueux incolore, presque inodore[1] Propriétés chimiques Formule brute C4H10O2 [Isomères] Masse molaire[2] 90,121 ± 0,0045 g·mol-1
C 53,31 %, H 11,18 %, O 35,51 %,Propriétés physiques T° fusion < -50 °C[1] T° ébullition 207 °C[1] Solubilité miscible à l'eau[1] Masse volumique 1,01 g·cm-3 (20 °C)[1] T° d'auto-inflammation 375 °C[1] Point d’éclair 109 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,8 Vol.-%
15,7 Vol.-% [1]Pression de vapeur saturante 0,08 mbar à 20 °C[1] Viscosité dynamique 96 mPa·s à 25 °C[1] Précautions Directive 67/548/EEC[1] Écotoxicologie DL50 12 980 mg·kg-1 (souris, oral)[3]
10 276 mg·kg-1 (souris, i.p.)[4]Unités du SI & CNTP, sauf indication contraire. Le butane-1,3-diol est un composé organique de la famille des diols. C'est l'un des isomères du butanediol.
Sommaire
Propriétés physico-chimiques
Le butane-1,3-diol est un liquide visqueux incolore, presque inodore. C'est un liquide très peu inflammable (point d'éclair supérieur à 100 °C), totalement miscible à l'eau, hygroscopique et légèrement volatil.
Le troisième carbone de la chaine est asymétrique, le butane-1,3-diol existe donc sous deux énantiomères différents.
Production et synthèse
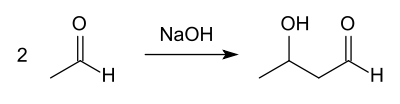
Elle est faite par aldolisation de l'éthanal sur lui même en catalyse basique (transformation d'un éthanal en éthylénolate, qui s'additionne sur un autre éthanal) donnant dans un premier temps le 3-hydroxybutanal :
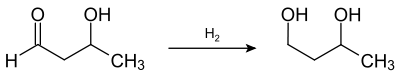
Ce dernier est ensuite hydrogéné en butane-1,3-diol, réaction catalysée par exemple par le Nickel de Raney[5] .
Il est également possible de produire ensuite par une double déshydratation le buta-1,3-diène.
Utilisation
Le butane-1,3-diol est souvent utilisé comme solvant pour arômes alimentaires. Il est aussi utilisé comme co-monomère dans la synthèse de polyuréthane et des résines polyester. En biologie, il est utilisé comme agent hypoglycémique.
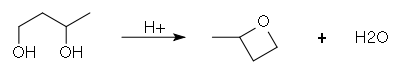
Le butane-1,3-diol peu aussi se cycliser sous catalyse acide, pour former le 2-méthyloxétane
Notes et références
- Entrée de « 1,3-Butanediol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20/11/2010 (JavaScript nécessaire)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Journal of the American Pharmaceutical Association, Scientific Edition. Vol. 45, Pg. 669, 1956.
- Toxicology and Applied Pharmacology. Vol. 49, Pg. 385, 1979 PMID
- Römpp CD 2006, Georg Thieme Verlag 2006
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « 1,3-Butandiol » (voir la liste des auteurs)
Wikimedia Foundation. 2010.