- Salicylaldéhyde
-
Salicylaldéhyde 
Général Nom IUPAC 2-hydroxybenzaldéhyde Synonymes salicylal
aldéhyde salicylique
o-hydroxybenzaldéhyde
2-formylphénolNo CAS No EINECS No RTECS PubChem SMILES InChI Apparence liquide jaunâtre à l'odeur d'amande amère[1] Propriétés chimiques Formule brute C7H6O2 [Isomères] Masse molaire[3] 122,1213 ± 0,0066 g·mol-1
C 68,85 %, H 4,95 %, O 26,2 %,pKa 6,79[2] Propriétés physiques T° fusion -7 °C[1] T° ébullition 197 °C[1] Solubilité 14 g·l-1 (eau)[1]
Soluble dans les alcools et dans l'éther[4].Masse volumique 1,17 g·cm-3 (20 °C)[1] Point d’éclair 79 °C (coupelle fermée)[1] Limites d’explosivité dans l’air non explosif[4] Pression de vapeur saturante 0,77 mbar à 25 °C[1] Conductivité électrique 1,64×10-5 S·m-1 (25 °C)[1] Propriétés optiques Indice de réfraction  1,5730[5]
1,5730[5]Précautions Directive 67/548/EEC[1] 
XnPhrases R : 21/22, 36/38, 68, Phrases S : 26, 36/37, Transport[1] Pas de régulation NFPA 704[4] SGH[4] H302, H315, H319, H335, P261, P321, P302+P352, P305+P351+P338, P405, P501, Écotoxicologie DL50 504 mg·kg-1 (souris, oral)[6]
231 mg·kg-1 (souris, i.p.)[7]LogP 1,81[1] Unités du SI & CNTP, sauf indication contraire. Le salicylaldéhyde (2-hydroxybenzaldéhyde) est un composé organique aromatique de formule C6H4CHO-2-OH[8]. Avec le 3-hydroxybenzaldéhyde et le 4-hydroxybenzaldéhyde, c'est l'un des trois isomères de l'hydroxybenzaldéhyde. Il est présent à l'état naturel dans certains végétaux et certains insectes. Il est aujourd'hui présent dans de nombreux parfums et est utilisé dans de nombreuses industries chimiques et pharmaceutiques.
Sommaire
Historique
Vers 1838, le pharmacien suisse Johann Pagenstecher a obtenu du salicylaldéhyde à partir de la fleur de la reine-des-prés (Filipendula), ce qui fut la première étape vers la découverte de l'acide acétylsalicylique (aspirine)[9].
Occurrence naturelle
Certains insectes, notamment les Chrysomelidae, le produisent naturellement, contre leurs prédateurs, dans des glandes spéciales à partir de la salicyline que produisent leurs plantes-hôtes. Il est aussi produit par la reine-des-prés. Le salicylaldéhyde a aussi été identifié comme l'un des composé de l'odeur caractéristique du sarrasin[10].
Propriétés
Le salicylaldéhyde se présente sous la forme d'un liquide de couleur jaunâtre, avec une odeur d'amande amère à haute concentration, et l'odeur caractéristique du sarrasin à plus faible concentration. Le salicylaldéhyde est un allergène de contact[11].
Le salicylaldéhyde se décompose lorsqu'il est chauffé, notamment en oxydes de carbone (monoxyde et dioxyde), et forme des vapeurs et gaz irritants[1].
Il peut réagir dangereusement avec des oxydants forts, des bases fortes et des acides forts[1].
Synthèse
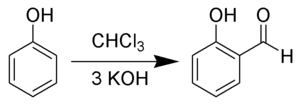
Historiquement, le salicylaldéhyde est synthétisé par la réaction de Reimer-Tiemann (découverte en 1876, aux débuts de la chimie du carbone)[12], où l'on fait réagir le phénol avec du chloroforme et de l'hydroxyde de potassium :
Aujourd'hui cette réaction a été améliorée par un processus de catalyse par transfert de phase.
Utilisation
Le salicylaldéhyde est un intermédiaire dans l'industrie pharmaceutique et dans la fabrique de teintures. Il est aussi utilisé comme ingrédient dans la parfumerie.
En solution alcoolique à 10% il sert à détecter les cétones (par exemple l'acétone dans les urines) et les alcools de fusel dans l'alcool.
Précurseur
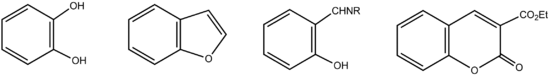
Le salicylaldéhyde est un dérivé benzénique hautement fonctionnel qui est utilisé comme précurseur à de nombreux autres composé chimiques. On peut notamment citer ci-dessous, de gauche à droite, le catéchol, le benzofurane, un salicylaldéhydimine (R = alkyle ou aryle), et la 3-carbéthoxycoumarine.
Réactions
Le salicylaldéhyde peut subir un certain nombre de réactions.
- Le salicylaldéhyde peut être convertir en ligand chélateur par condensation avec des amines. Condensé avec l'éthylènediamine, il donne le salen, un ligand diprotique, et son dérivé la salcomine. La condensation avec l'hydroxylamines donne la salicylaldoxime.
- Son oxydation avec le peroxyde d'hydrogène (réaction de Dakin)[13] donne le catéchol (1,2-dihydroxybenzène).
- Par aldolisation avec le malonate de diéthyle (oxydation de Perkin), il donne un dérivé hétrocyclique, la coumarine[14].
- Par synthèse de Williamson avec l'acide chloroacétique suivi d'une cyclisation, il donne le benzofurane[15], un autre composé hétérocyclique. La première étape de cette réaction menant à la formation d'un benzofurane substitué est appelée « condensation de Rap-Stoermer » d'après E. Rap (1895)[16] et R. Stoermer (1900)[17].
Notes et références
- Entrée de « 2-Hydroxybenzaldehyde » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 mars 2011 (JavaScript nécessaire)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Fiche Alfa Aesar, consultée le 18 mars 2011
- http://www.alfa.com/fr/GP100W.pgm?DSSTK=A13833&rnd=274012060
- National Technical Information Service. Vol. OTS0533438
- Chemotherapy Vol. 16, Pg. 371, 1971. PMID
- Merck Index, 11th Edition, 8295
- (de)C. Exner, H. Dapper: Die Weide lieferte Salicylsäure. Der Mensch machte Aspirin. Ein Medikament wird hundert Jahre alt.
- Janes D, Kreft S: Salicylaldehyde is a characteristic aroma component of buckwheat groats, Food Chemistry 2008; 109: 293-298, DOI:10.1016/j.foodchem.2007.12.032
- (de) Informations sur les allergène de contact – Salicylaldéhyde
- P. Rademacher: Organische Chemie IV.
- Dakin, H. D. (1941). "Catechol". Org. Synth.; Coll. Vol. 1: 149.
- Horning, E. C.; Horning, M. G.; Dimmig, D. A. (1955). "3-Carbethoxycoumarin". Org. Synth.; Coll. Vol. 3: 165.
- Burgstahler, A. W.; Worden, L. R. (1973). "Coumarone". Org. Synth.; Coll. Vol. 5: 251.
- E. Rap, Gazz. Chim. Ital. 285 (1895) 2511; b)
- R. Stoermer, Liebigs. Ann. Chem. 312 (1900) 331.
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Salicylaldehyde » (voir la liste des auteurs) et en allemand « Salicylaldehyd » (voir la liste des auteurs)
Wikimedia Foundation. 2010.