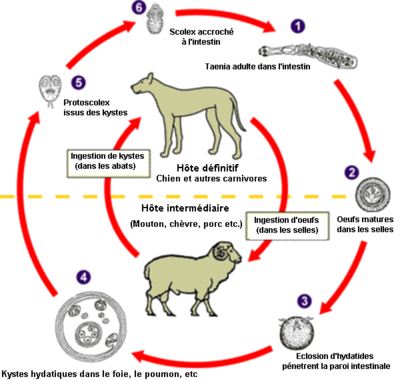
- Échinococcose cystique
-
Échinococcose
L'échinococcose est une zoonose provoquée par un ver échinocoque. En Europe, il s'agit principalement d'Echinococcus multilocularis, mais il existe d'autres échinocoques parasites, dans presque toutes les régions du monde.
Une échinococcose peut être cystique (causée par Echinococcus granulosus), hydatique (Echinococcus granulosus), alvéolaire (E. multilocularis), ou polycystique (E. vogeli ou E. oligarthrus).
Sommaire
Contamination humaine
 La plupart des victimes d'échinococcose sont propriétaires d'un chien et/ou pratiquent le jardinage
La plupart des victimes d'échinococcose sont propriétaires d'un chien et/ou pratiquent le jardinage
L'homme est réputé pour se contaminer accidentellement en ingérant les œufs microscopiques du parasite :
- contact à la bouche par des mains souillées ;
- - au contact direct avec des animaux parasités (chien et chat principalement, et éventuellement campagnol, renard ou autres canidés). Le léchage par les chiens et chat, ou le fait de les laisser manger dans nos assiettes est une source de risque.
- - en manipulant de la terre, elle-même souillée (La plupart des malades possèdaient un chien et pratiquaient le jardinage au moment supposé de la contamination)
- par la consommation de plantes et fruits souillés
L'échinocoque est insensible à la congélation, mais il est tué par la chaleur (cuisson). Par ailleurs, il a besoin d'un minimum d'humidité pour survivre. Le séchage à l'air ou au four est donc une bonne solution pour éliminer les oeufs. Un lavage soigneux des plantes ou fruit issue de la cueillette est recommandé bien que peu efficace.
Pathogénèse
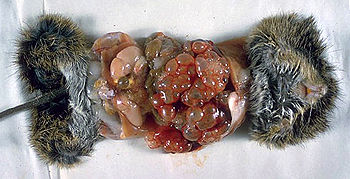
Les œufs ingérés se transforment en larves qui vont coloniser le foie et former une pseudo-tumeur au bout de plusieurs années. Les larves peuvent exceptionnellement également atteindre d'autres organes comme les poumons ou le cerveau. Curieusement les enfants semblent épargnés par cette maladie alors que ce sont ceux qui portent le plus les mains à la bouche et se font lécher par les chiens et chats. Leur système immunitaire semble facilement se débarrasser des échinocoques.
Les modes de transmission d’Echinococcus multilocularis restent mal compris même si la chaîne alimentaire et les fèces provenant des animaux contaminés semblent être la source de contagion la plus probable. On ne sait pas si l’épidémie s’étend rapidement ou si l’on avait antérieurement sous-estimé la prévalence de l’échinocoque. Il est possible que certaines souches d'échinocoque soient plus virulentes ou moins reconnues par certains systèmes immunitaires.
Signes cliniques et traitement
L'échinococcose alvéolaire est une maladie grave qui se développe lentement et de manière asymptomatique, autrefois souvent confondues avec cirrhose ou cancer du foie : douleurs abdominales, jaunisse, fièvre, avec augmentation du volume du foie.
 Le campagnol des champs (Microtus arvalis) ; l'une des espèces susceptibles en Europe d'abriter le stade intermédiaire du parasite (on parle d'espèce-réservoir)
Le campagnol des champs (Microtus arvalis) ; l'une des espèces susceptibles en Europe d'abriter le stade intermédiaire du parasite (on parle d'espèce-réservoir)
Le seul traitement curatif existant peut être une intervention chirurgicale avec une éventuelle greffe du foie, mais la maladie reste gravissime pour le contaminé. L'albendazole est le seul traitement oral disponible en France pour cette maladie. Il ne fait que ralentir la progression de la maladie, sans l'éradiquer.
Prévention
Le parasite résiste à la congélation mais est tué par la chaleur.
Il peut être conseillé de mettre un masque de protection si par exemple vous avez à "manipuler" de la terre ou "manipuler" du foin (en dehors du fait qu'il est conseillé d'utiliser un masque si l'on manipule régulièrement du foin pour éviter des maladies pulmonaires liées spécifiquement au foin).
Zones à risque
Dans le monde les zones touchées sont presque toutes les zones de moyenne montagne, avec couverture de neige plusieurs mois par an, favorables aux rongeurs de type campagnol. En France, les études de terrain et cartes de cas [1] [2](sachant qu'une personne peut déclarer la maladie dans une région, mais l'avoir acquise dans une autre) montre que les zones de virulence sont la Franche-Comté, la Lorraine, les Alpes, le Massif Central, et les Ardennes. On rapporte cependant quelques cas hors de ces régions. On estime actuellement qu'il y a une douzaine de cas traités chirurgicalement en France par an.
Au Japon, les campagnols prairiaux n’existent pas. Là, Clethrionomys rufocanus, un rongeur forestier, est l’hôte intermédiaire principal de l'échinocoque. Ailleurs dans le monde, ce sont toujours des campagnols ou rongeurs prairiaux qui semblent être le réservoir du parasite, mais chiens et chats, sont avec les renards, le fennecs, et d'autres canidés, les vecteurs vers l'homme.
M. agrestis et/ou M. arvalis ?
En Europe, ces deux espèces sont difficile à différencier sans disposer de la mâchoire ou d’un moyen d’analyse génétique (coûteux).
En 2006, on ne savait pas encore en Europe si des rongeurs forestiers peuvent aussi y entretenir le cycle de l’échinococcose. (La prévalence du parasite est généralement inférieure à 1%.)
Le campagnol est un animal souterrain parfois discret (en forêt) et difficile à étudier. On ne connait pas le pourcentage des campagnols agrestes au sein du genre Microtus (détermination impossible au vu des seuls indices : traces, crottes..)Sans analyse (coûteuse) du lien entre répartition spatiale, charge parasitaire et polymorphisme génétique des échinocoques trouvés, on ne sait pas si un parasite découvert dans une région jugée antérieurement épargnée signifie qu’il en était absent (mais non détecté car non recherché) ou s’il s’agit d’une émergence réelle, ou d’une simple augmentation de prévalence chez les campagnols. (Romig et al., 1999a). De plus les déplacements par l’homme de gibiers et de chiens d’une région à l’autre pourraient déjà avoir troublé les cartes en diffusant des parasites. On a déjà trouvé des génotypes parasitaires différents au sein d’une même population de renard, sans qu’on ai pu à ce jour mesurer leurs différences de virulence, contagiosité ou prévalence selon les polymorphismes.
Pistes de recherche
Définir des zones à risque : Pour cela, on cherche d’éventuelles corrélations entre densités de campagnols (microtus), leur degré de prédation par les renards et d'autres carnivores (dont chiens et chats) et la prévalence réelle d’échinocoques.
Mieux détecter : Il est possible que de nombreuses zones de prévalence à bas taux d'infection n'aient pas été détectées faute d'y avoir recherché le parasite.
Ainsi, une thèse (2006) a-t-elle a montré une forte prévalence d’E. multilocularis chez les renards des Ardennes françaises (Microtus étant le réservoir probable) dans une zone antérieurement considérée comme épargnée par l’endémie et où l’on a jamais signalé de pullulation de campagnols. Deux génotypes du parasite y ont été trouvés, identiques à ceux d’autres régions françaises, de Pologne, Slovaquie, Autriche, Suisse et Allemagne historiquement reconnues endémiques.Approche écoépidémiologique : L’université de Franche-Comté a depuis longtemps noté – à échelle régionale – de fortes variations locales de prévalences et de charge parasitaire, selon l’altitude, l'écologie du paysage et, au sein des paysages, selon le « grain écopaysager » qui caractérise la structure et l’hétérogénéité éco-paysagère, variations confirmées dans d’autres régions du monde (dont dans le canton de Zhang (Sichuan, Chine) où une forte prévalence de la maladie existe chez l’homme).
Les caractéristiques écopaysagères influent en effet sur le risque ;
- - via la probabilité pour le renard de consommer des hôtes intermédiaires,
- - via la vitesse de décomposition des fèces[3]
- - via la survie des œufs d’échinocoques (Cf. humidité et condition du sol qui varie selon l’hydromorphie, le drainage, pâturage, jachères, zones fréquentées par l’homme, etc. [4].
La durée de vie des fèces et des œufs : ce facteur reste à étudier in situ. Elle doit varier selon le milieu et des conditions climatiques (activité des coprophages, vers de terre, etc). Marie-Hélène Guislain (voir note de pas de page) suggère d'étudier la vitesse de décomposition de fèces de renards (élevés en captivité avec des régimes alimentaires connus), dans des conditions microclimatiques et environnementales variées, pour mieux identifier d’éventuelles « zones à risque, là où ces fèces seraient plus présentes ou plus "biodisponibles" ;
On s’intéresse aux œufs présent dans les fèces, mais on mesure mal la quantité excrétée par les canidés, félins et d’autres animaux, et on ne sait pas combien d’entre eux survivent ni combien de temps aux attaques virales, fongiques et bactériennes ou à l’ingestion par des animaux coprophages et détritivores dans l’environnement réel.
Détecter le parasite là où sa prévalence est très basse reste très difficile, mais pourrait se faire grâce aux techniques biomoléculaires basées sur des cible microsatellitaire (EmsB). elles permettraient de mieux évaluer la variation génotypique des vers, mais aussi d'évaluer celle des œufs présents dans l’environnement, pour détecter d’éventuels génotype écoépidémiologiquement plus « efficaces ».Mieux évaluer le risque : Le risque semble dépendre de la possibilité de contact entre le vecteur-hôte intermédiaire et l’œuf. Dans la « nature », il varie fortement selon le milieu considéré, et est a priori est plus élevé quand la densité de fèces infectées est élevée et quand le nombre de rongeurs est également élevé, dans la même zone, généralement sur les lisières, en zone de végétation intermédiaire entre forêt et prairie. Dans nos paysages, hormis au moment des coupes rases, les lisières sont fixes alors qu’elles se déplaceraient dans le temps dans la nature sauvage. Le parasite pourrait y trouver des conditions favorables. De plus la fragmentation des paysages (et en particulier des forêts) a fortement accru le nombre de ces lisières « fixées ».
Les taux de transmission parasitaire doivent être estimés selon les milieux, ce qui implique des captures massives de rongeurs prairiaux (et forestier ?) pour en permettre le diagnostic, l’estimation de la densité et détecter d’éventuelles corrélations avec la présence et le taux de parasites dans les fèces ou dans le sol.
Le comportement du renard est lui-même modifié par la fréquentation humaine, des chiens et/ou par la chasse qu’on lui donne, ainsi que par diverses modifications anthropiques du paysage, ce qui peut modifier la répartition et localisation de ses fèces dans l’environnement, et sa consommation d’hôtes intermédiaires contaminé.
Éco-éthologie : Les œufs d’échinocoques ne sont pas mobiles dans l’Environnement. Les rongeurs prairiaux ne se déplacent que sur des distances inférieures à quelques centaines de mètres au plus, et généralement moins de quelques dizaines de mètres[5]. Chiens, chats et renards pour se contaminer doivent donc venir manger un campagnol contaminé, ou se déplacer dans un site où un renard (ou autre carnivore) contaminé a déféqué.
Or, leurs déplacements sont également influencés par les lisières artificielles fixes imposées par l’homme au paysage (Cf. Propriété privée), qu’on sait propices aux rongeurs réservoir intermédiaire. L’étude des terrains de chasses et des lieux de défécation communs à plusieurs renards (Poulle et al., 1994; Henry et al., 2005) , ou à des renards et chiens et chats présente un intérêt éco-épidémiologique. Ici encore, des marqueurs microsatellites détectables dans les fèces permettraient de mieux mesurer la dispersion de fèces de renards peu ou très contaminés, et aiderait à comprendre comment le parasite se disperse dans le paysage. Cette méthode a déjà été utilisée pour compter des blaireaux (Meles meles) en Angleterre[6], le wombat commun (Vombatus ursinus) en Australie[7] ou des outardes barbues (Otis tarda) au Maroc[8].Enfin, le rôle du chien et du chat comme vecteur du parasite vers l'homme pourrait avoir été sous-estimé.
Voir aussi
- épidémiologie
- écoépidémiologie
- Echinococcus granulosus (qui semble présent dans le monde entier)
- Echinococcus multilocularis (Hémisphère nord)
- Echinococcus vogeli (Amérique centrale et du sud).
- Echinococcus oligarthrus (Amérique centrale et du sud).
- Parasitisme
- Interactions durables
- Jacques Euzéby (parasitologue)
Liens externes
- Thèse : Une maladie émergente ; l’échinococcose alvéolaire (par Marie-Hélène Guislain, Université de Franche Comté, France, 2006, 163 pages)
- Site du ministère français de la santé (voir dossiers par ordre alphabétique, Z, Zoonoses)
- Laboratoire de Biologie Environnementale Besançon-Montbéliard (INRA/ Université de Franche Comté)
Notes et références
- ↑ Carte des cas humains de 1982 à 2001, en France, publiée parle réseau SAGIR/ONCFS, lettre n°149, p 5 sur 12
- ↑ Site de référence europée (en 3 langues), avec nombreuses cartes
- ↑ WHO (2000) World health report – 2000. World Health Organization. Geneva, Switzerland. Williams, B., Warren, J., 2003. Effects of spatial distribution on the decomposition of sheep faeces in different vegetation types. Agric., Ecosyst. Environ., 103, 237-243.
- ↑ Graham, A.J., Danson, F.M., Giraudoux, P., Craig, P.S. (2004) Ecological epidemiology: landscape metrics and human alveolar echinococcosis. Acta Trop., 91, 267-278.
Danson, F.M., Craig, P.S., Man, W., Shi, D., Giraudoux, P. (2004) Landscape dynamics and risk modeling of human alveolar echinococcosis. Photogramm. Eng. Remote Sens., 70, 359-366 - ↑ Spitz, F. (1977) Le campagnol des champs (Microtus arvalis (Pallas)) en Europe. Bull. OEPP,7, 165-175.;
Airoldi, J.P. (1978) Étude par capture et recapture d’une population de Campagnols terrestres Arvicola terrestris scherman Shaw. Rev. Ecol. (Terre Vie), 32, 3-45. - ↑ Wilson, G.J., Frantz, A.C., Pope, L.C., Roper, T.J., Burke, T.A., Cheeseman, C.L., Delahay, R.J. (2003) Estimation of badger abundance using faecal DNA typing. J. Applied Ecol., 40, 658-666.
- ↑ Banks et al., 2002
- ↑ Idaghour et al., 2003
- Portail de la médecine
Catégorie : Infection parasitaire - contact à la bouche par des mains souillées ;
Wikimedia Foundation. 2010.