- Azide
-
Azoture
Les azotures sont les sels de l'acide azothydrique HN3, ainsi que les azotures organiques dans lesquels un des atomes d'azotes est lié de façon covalents avec un atome de carbone d'un composé organique. Les azotures organiques peuvent par exemple être obtenus par substitution d'un halogénure ou un sulfonate d'alkyle par un azoture inorganique. L'action des sels d'azotures sur les halogénures d'acyle conduit à la formation d'azotures d'acyles possédant une réactivité particulière. L'usage du mot anglais azide à la place d'azoture se répand en français, mais le seul terme correct reste bien azoture.
Sommaire
Structure électronique
La structure de l'ion azoture est linéaire :
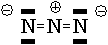

Ceci est la forme mésomère majoritaire.
Réactivité des azotures ioniques
Comme l'acide azothydrique, ils sont particulièrement oxydants, corrosifs, toxiques et instables (explosifs). Le diagramme de Frost de l'azote (ci-bas) permet de bien comprendre cette instabilité et ce caractère fortement oxydant. Le potentiel redox du couple HN3/NH4+ vaut par exemple 1,47 V.
Ainsi on comprend mieux le danger qui apparaît lorsque l'on laisse une solution d'azoture de sodium au contact de métaux lourds : l'ion azoture oxyde ces métaux (au degré + II le plus souvent), et il se forme des cristaux de M2+(N3-)2, explosifs. Il en est ainsi avec le cuivre, le plomb...
Ces réactions sont souvent violentes, ainsi que celles avec le sulfure de carbone CS2 ou le sulfate de diméthyle (CH3)2SO4. Dans ce dernier cas, il y a substitution rapide (S-N2) pour donner lieu à la formation d'azoture de méthyle CH3N3.
Il ne faut donc pas les confondre avec les nitrures qui sont au contraire très stables.
Les azotures sont réducteurs, ainsi que le montre également le diagramme de Frost ci-contre. Il permet également de comprendre la facile formation in vivo de monoxyde d'azote à partir d'azoture de sodium [1],[2] , ainsi que l'existence d'une médiamutation avec les peroxynitrites.
Dosage
Les azotures peuvent être dosés[3] par des oxydants très puissants (permanganate de potassium KMnO4 ou Cérium IV) ou par médiamutation avec l'acide nitreux (il y alors dégagement d'azote).
NB : Les potentiels rédox standard[4] des deux couples concernés sont les suivants :
Azotures covalents : leur utilisation en chimie organique
Ces composés peuvent être formellement considérés comme des ylures de diazonium
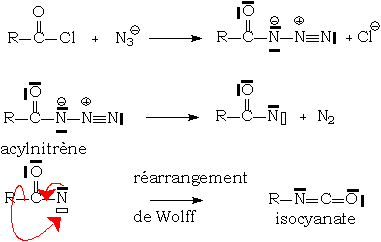
Acylazotures : réarrangement de Curtius
L'intérêt didactique de cette réaction est de bien montrer qu'un composé nucléophile (l'ion azoture) peut donner, par départ de la molécule de diazote extrêmement stable, un nitrène fortement électrophile, et donc oxydant. Ici, l'attaque électrophile se fait sur le doublet σ de la liaison R - CO.
Azotures d'alkyle
De la même manière que les azotures d'acyle, les azotures d'alkyle libèrent facilement de l'azote pour donner un nitrène fortement électrophile et oxydant. L'azoture de méthyle est particulièrement instable et explosif[5].
Le passage par les azotures est un moyen particulièrement simple d'obtenir une amine à partir d'un hydrocarbure halogéné ou d'un alcool primaire ou secondaire.
Réactions à partir d'un alcool par exemple :
R-CH2-OH + CH3-SO2-Cl → HCl + R-CH2-O-SO2-CH3 (mésylate)
R-CH2-O-SO2-CH3 + Na+,N3- → R-CH2-N3 + Na+,CH3-SO3-
R-CH2-N3 + H2 (platine) → R-CH2-NH2 + N2
Les meilleurs réducteurs sont l'hydrogène en présence d'un catalyseur tel que le palladium ou le platine et le tétrahydruroaluminate de lithium LiAlH4. Le tétrahydroruborate de sodium NaBH4 donne des rendements plus aléatoires[6] (il y a très souvent formation de l'alcool correspondant).
Le caractère oxydant des azotures d'alkyle se retrouve par exemple lors de la réaction de l'azidothymidine avec des thiols tels que le glutathion, le dithiothréitol (HS-CH2-CHOH-CHOH-CH2-SH), le mercaptoéthanol HS-CH2-CH2-OH. La réduction des azotures en amines par les thiols est d'ailleurs une méthode douce de réduction des azotures sensibles à l'hydrogénation catalytique sur un autre site fonctionnel[7]' [8].
Une méthode très douce de réduction des azoture qui se déroule en milieu neutre a été mise au point. Il s'agit de la réaction de Staudinger[9]' [10].
La triphénylphosphine joue le rôle de réducteur, le bilan avant hydrolyse faisant apparaitre un phosphazène et de l'azote :
R-N3 + PPh3 → R-N=PPh3 + N2
Puis l'hydrolyse libère l'amine et l'oxyde de triphénylphosphine :
R-N=PPh3 + H2O → R-NH2 + O=PPh3
Une modification de cette dernière réaction utilise le phosphite de triéthyle comme réducteur à la place de la triphénylphosphine : il s'agit du couplage phosphite-azoture[11]. L'azoture organique est également réduit en amine par ce composé du phosphore III.
Sécurité
L'azoture de sodium est très toxique (DL50 par voie orale (rats) = 27 mg/kg) et peut être absorbé par voie cutanée.
Il se décompose de manière explosive lorsqu'il est chauffé au-dessus de 275° et libère en particulier un volume important de diazote. Cette propriété est utilisée pour gonfler brutalement les coussins gonflables de sécurités de voiture.
Lors de l'acidification de la solution d'azoture de sodium, il y a formation de l'acide azothydrique, explosif.
La nucléophilie de l'ion azoture est suffisante pour former les diazoturométhane et triazoturométhane par réaction avec le dichlorométhane et le chloroforme. Ces deux composés sont extrêmement toxiques et explosifs, ainsi qu'il l'a été rapporté par A. Hassner et al. [12].
Notes et références
- ↑ Sodium azide as indirect nitric oxide donor: researches on the rat aorta isolated segments ; Ukr Biokhim Zh. 2005 Jul-Aug;77(4):120-3
- ↑ Cellular signaling with nitric oxide and cyclic GMP Murad F; Braz. J.M.B.R. (1999) 32; 1317-1327
- ↑ Méthodes de dosage : G. Charlot, Chimie Analytique Quantitative, tome II, Masson, 1974
- ↑ Potentiels rédox standard : James E. Huhey, Inoganic chemistry, Harper & Row, New York,1972
- ↑ Travers MJ Cowles DC Clifford EP Ellison GB Journal of chemical physics ; Vol 111, 12 ; 1999 Photoelectron spectroscopy of the CH3N- ion
- ↑ Brindaban CR Arunkanti S Reduction of azides with zinc borohydride ; J. Org. Chem. 1994, 59, 4114-4116
- ↑ Handlon AL. Oppenheimer NJ. Thiol reduction of 3'-azidothymidine to 3'-aminothymidine: kinetics and biomedical implications ; Pharm Res. 1988 May;5(5):297-9
- ↑ Reardon JE. Crouch RC. St.John-Williams L Reduction of 3'-azido-3'-deoxythymidine (AZT) and AZT Nucleotides by thiols ; Journal of Biological Chemistry Vol. 269, Issue of June 10, pp. 15999-16008, 1994
- ↑ Staudinger Reaction
- ↑ Hermann Staudinger
- ↑ A. Koziara, K. Osowska-Pacewicka, S. Zawadzki, and A. Zwierzak, Synthesis 202 (1985)
- ↑ A. Hassner et al., Angew. Chem. Int. Ed. Engl., 25, 479 (1986), J. Org. Chem., 55, 2304 (1990).
Voir aussi
Liens externes
- De nombreux liens et publications sur le site de l'Institut de chimie organique de l'Université de Karlsruhe
- Réaction de Staudinger
- La fiche de l'azoture de sodium sur le site de l'IRSST;
- Portail de la chimie
Catégories : Azoture | Ion | Base
Wikimedia Foundation. 2010.

