- Acide Azothydrique
-
Acide azothydrique
Azoture d'hydrogène 
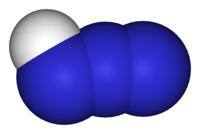
Structure de l'azoture d'hydrogène Général Nom IUPAC acide azothydrique No CAS No EINECS SMILES Apparence liquide incolore [1] Propriétés chimiques Formule brute HN3 [Isomères] Masse molaire 43,028 g∙mol-1
H 2,34 %, N 97,66 %,pKa 4.6 à 4.7 Propriétés physiques T° fusion -80 °C[1] T° ébullition 35,7 °C[1] Masse volumique 1,09 g/cm³ (25 °C)[1] Précautions Directive 67/548/EEC 
T+
ESIMDUT[2] Produit non classifié Unités du SI & CNTP, sauf indication contraire. L'acide azothydrique, HN3, est un monoacide faible (pK = 4,72), acide conjugué de l'ion azoture N3-.
Sa représentation de Lewis est la suivante :
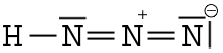
Sommaire
Description
C'est un hydracide. On le désigne également par les noms d'acide hydrazoïque et d'azoture d'hydrogène. Le nom d'azoture d'hydrogène désigne en principe le corps pur (HN3 gazeux), alors que celui d'acide azothydrique ou hydrazoïque désigne plutôt la solution aqueuse.
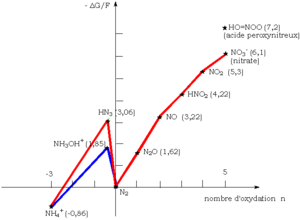
C'est un oxydant très puissant, ainsi que le montre le diagramme de Frost de l'azote ci-contre. Il est instable, très explosif.
Il est synthétisé par action de l'acide nitreux sur l'hydrazine
(HNO2 + N2H4 → N2H5NO2 → HN3 + 2H2O)
ou par action du trichlorure d'azote ou du chlorure de nitrosyle sur l'hydrazine, ou par réaction d'un azoture avec un acide.
Toxicité
Des travailleurs exposés à 0,5 ppm d’acide azothydrique ont présenté des céphalées et une congestion nasale. D’autres symptômes, tels qu’une faiblesse et une irritation oculaire et nasale, ont pu être observés par suite d’une exposition à 3 ppm pendant moins d’une heure. La fréquence du pouls était variable et la tension artérielle basse ou normale. Des symptômes similaires ont été rapportés parmi des travailleurs employés à la production de l’azoture de plomb. Ils ont présenté une nette hypotension, qui s’est accentuée au cours de la journée de travail et qui est revenue à la normale après qu’ils ont quitté leur poste.
L’exposition de rongeurs à des vapeurs d’acide azothydrique provoque une inflammation pulmonaire aiguë. Les vapeurs de cet acide sont environ huit fois moins toxiques que celles du cyanure d’hydrogène, une concentration de 1 024 ppm étant mortelle pour la souris après 60 minutes (contre 135 ppm pour le cyanure d’hydrogène).[3]
Voir aussi
Références
- ↑ a , b , c et d Entrée de « Hydrazoic acid » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 31 mars 2009 (JavaScript nécessaire)
- ↑ « Acide hydrazoïque » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Encyclopédie de sécurité et de santé au travail http://www.ilo.org/public/french/protection/safework/cis/products/encyclo/pdf/vol4/4104chff.pdf
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique explosif | Acide | Azoture
Wikimedia Foundation. 2010.