- Dibrome
-
Dibrome 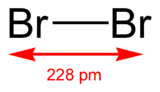
Dibrome Général No CAS No EINECS Apparence liquide fumant ,rouge à brun, d'odeur acre[1]. Propriétés chimiques Formule brute Br2 [Isomères] Masse molaire[2] 159,808 ± 0,002 g·mol-1
Br 100 %,Propriétés physiques T° fusion -7,2 °C[1] T° ébullition 58,8 °C[1] Solubilité dans l'eau à 20 °C : 31 g·l-1[1] Masse volumique (eau = 1) : 3,1 g·ml-1[1] Pression de vapeur saturante à 20 °C : 23,3 kPa[1] Viscosité dynamique 0,314 mm2·s-1
Viscosité cinématique à 20 °CPoint critique 103,0 bar, 314,85 °C [4] Thermochimie Cp Cristallographie symbole de Pearson  [5]
[5]Classe cristalline ou groupe d’espace Cmca (n°64)[5] Strukturbericht A14[5] Structure type I2[5] Précautions Directive 67/548/EEC 
T+
C
NPhrases R : 26, 35, 50, Phrases S : 1/2, 7/9, 26, 45, 61, [6] Transport 886 1744 [7]NFPA 704 SIMDUT[8] 

SGH[9] 


DangerÉcotoxicologie Seuil de l’odorat bas : 0,0099 ppm
haut : 0,46 ppm[10]Unités du SI & CNTP, sauf indication contraire. Le dibrome est une molécule composée de deux atomes de brome, notée Br2. C'est l'unique forme moléculaire (allotrope) de l'élément brome.
Le dibrome est un liquide toxique, lorsqu'il est en solution il est aussi appelé « eau de brome ». Il est très toxique par inhalation et provoque de graves brûlures.
Sommaire
Propriété oxydante
Le dibrome a un pouvoir oxydant élevé : E°(Br2/Br-) = 1,07 V.
Ainsi, l'eau de brome permet de mettre en évidence la présence d'une double liaison (voir Test au dibrome) en l'oxydant.
Précautions
Du fait de son fort pouvoir oxydant, et parce qu'il est extrêmement volatil, le dibrome dégage des vapeurs toxiques, suffocantes et rougeâtres.
Au contact de la peau, il engendre des plaies qui cicatrisent très lentement.
En cas de besoin, consulter sa fiche toxicologique sur le site de l'INRS [1]
Lien externe
- Récapitulatif des propriétés physiques, chimiques et de la toxicologie du produit [2]
Voir aussi
Références
- BROME, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 978-0-07-049841-9), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- The Molecular Iodine (I2) Crystal Structure (A14) sur http://cst-www.nrl.navy.mil/. Consulté le 17 décembre 2009
- « brome » sur ESIS, consulté le 11 février 2009
- Entrée du numéro CAS « 7726-95-6 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire)
- « Brome » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Bromine sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
Catégories :- Produit chimique très toxique
- Produit chimique corrosif
- Produit chimique dangereux pour l'environnement
- Produit chimique comburant
- Composé du brome
Wikimedia Foundation. 2010.











