- Signe de Romaña
-
Maladie de Chagas
Maladie de Chagas CIM-10 : B57 La trypanosomiase américaine (brésilienne) ou maladie de Chagas est une forme de trypanosomiase (comme la maladie du sommeil), une maladie parasitaire qui sévit dans les régions tropicales d'Amérique du Sud et centrale. Elle est provoquée par Trypanosoma cruzi, un trypanosome qui est transmis par des punaises hématophages des genres Triatoma et Rhodnius (famille des réduvidés, telles la vinchuca (Triatoma infestans, Triatoma protracta et Rhodnius prolixus). Selon l'OMS près de 13 000 personnes meurent du mal de Chagas et 300 000 nouveaux cas se déclarent chaque année. Elle porte le nom d'un médecin brésilien, Carlos Chagas, qui en 1909 décrivit la maladie pour la première fois.
Sommaire
Histoire
La maladie a été baptisée du nom du médecin brésilien spécialiste des maladies infectieuses Carlos Chagas, qui l'a décrite pour la première fois en 1909. [1]'[2]'[3] Mais, la maladie n'a pas été considérée comme un problème majeur de santé publique chez l'homme avant les années 1960 (les manifestations de la maladie de Chagas au Brésil dans les années 1920 ont été largement ignorées).[4]
Il a découvert que les intestins des Triatomae hébergeaient un protozoaire flagellé, une nouvelle espèce du genre Trypanosoma et parvint à prouver expérimentalement qu'il pouvait être transmis aux singes marmousets qui avaient été piqués par l’insecte infecté.
Chagas a appelé le parasite pathogène qui provoque la maladie Trypanosoma cruzi , [1] et plus tard la même année, Schizotrypanum cruzi [5], à la fois pour honorer Oswaldo Cruz, le remarquable médecin et épidémiologiste brésilien qui avait combattu avec succès des épidémies de fièvre jaune, de variole, et de peste bubonique à Rio de Janeiro et dans d'autres villes au début du XXe siècle. Le travail de Chagas est unique dans l’histoire de la médecine parce qu'il fut le seul chercheur jusqu'à maintenant à décrire complètement une nouvelle maladie infectieuse : son agent pathogène, son vecteur, son hôte, ses manifestations cliniques et son épidémiologie. Néanmoins, il a cependant cru à tort jusqu'en 1925, que la principale source d'infection était la piqûre de l'insecte - et non ses déjections - comme l’avait proposé son collègue Emile Brumpt en 1915 et comme l’avaient confirmé Silveira Dias en 1932, Cardoso en 1938 et Brumpt lui-même en 1939. Chagas fut également le premier à découvrir et illustrer le parasite du genre fongique Pneumocystis, (qui sera connu bien plus tard pour être la cause de la pneumocystose de sinistre réputation chez les victimes du SIDA). [2].
La confusion entre les cycles de vie des deux agents pathogènes l'a conduit à le classer brièvement dans un genre nouveau Schizotrypanum, mais après la description de Pneumocystis considéré par d'autres comme faisant partie d’un genre indépendant, Chagas est revenu à l'appellation Trypanosoma cruzi .
Sur un autre point d’histoire, on a supposé que Charles Darwin pouvait avoir souffert de cette maladie à la suite d'une piqûre du prétendu grand moustique noir de la pampa (vinchuca) (voir la maladie de Charles Darwin). L'épisode a été rapporté par Darwin dans ses journaux intimes dans « le voyage du Beagle » comme étant survenu en mars 1835 à l'est des Andes près de Mendoza. Darwin était jeune et en bonne santé bien que six mois auparavant il ait été malade pendant un mois près de Valparaiso, mais en 1837, presque un an après son retour en Angleterre, il a commencé à souffrir par intermittence d'un étrange groupement de symptômes, le frappant d'incapacité pratiquement pour tout le reste de sa vie. Les tentatives faites pour examiner les restes de Darwin conservés à abbaye de Westminster en utilisant les techniques modernes de PCR se sont heurtées à un refus du conservateur de l'abbaye. [6]
Épidémiologie et distribution géographique
La maladie de Chagas affecte actuellement 16 à 18 millions de personnes, avec quelque 100 millions d’autres (25% de la population latino-américaine) potentiellement exposées au risque de contracter la maladie, [3] tuant environ 50 000 personnes chaque année.[7]
La maladie de Chagas chronique demeure un problème de santé important dans de nombreux pays d’Amérique latine, en dépit de l'efficacité des mesures d'hygiène et de prévention, telles que l’élimination des insectes vecteurs de la transmission, qui ont réduit à zéro le nombre de nouvelles infections dans au moins deux pays de la région. Avec l’accroissement des mouvements de population, le risque de transmission par transfusion sanguine est cependant devenu plus réel aux États-Unis. [8] En outre, T.cruzi s'est déjà avéré capable d'infecter l'opossum sauvage et le raton laveur jusque loin au nord dans un État comme la Caroline du Nord.[9]
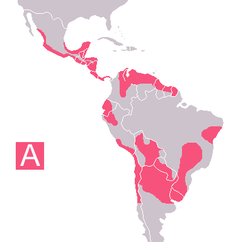
La maladie est présente dans presque toutes les Amériques, du sud des États-Unis au sud de l’Argentine, la plupart du temps dans des zones rurales pauvres, d’ Amérique centrale et d’Amérique du Sud. [10]
La maladie se rencontre presque exclusivement dans les zones rurales, où les Triatominae peuvent se multiplier et trouver leur nourriture sur un réservoir naturel de T.cruzi (le plus répandu étant l’opossum et le tatou). Selon les interactions locales entre les vecteurs et leurs hôtes, d'autres humains infectés, ainsi que les animaux domestiques comme les chats, les chiens, les cobayes et les animaux sauvages comme les rongeurs, les singes, les écureuils (Spermophilus beecheyi) et beaucoup d'autres pourraient également être d’importants réservoirs de parasite. Bien que les Triatominae se nourrissent sur les oiseaux, ceux-ci semblent être immunisés contre l'infection et donc ne sont pas considérés comme un réservoir de T. cruzi ; mais des soupçons demeurent sur leur rôle comme ressource alimentaire pour les vecteurs près des habitations humaines.
Les insectes du genre triatomine sont connus dans différents pays sous des noms populaires de vinchuca , de barbeiro (le barbier), de chipo et d'autres noms, [3] le qualifiant ainsi parce qu'il suce le sang la nuit en piquant le visage de ses victimes. Les insectes, qui développent un comportement principalement domiciliaire et anthropophile une fois qu’ils ont infesté une maison,[11] sont habituellement cachés pendant le jour dans les crevasses et les trous dans les murs et les toits des maisons mal construites. Plus rarement, les maisons mieux construites peuvent héberger l'insecte vecteur, en raison de l'utilisation des matériaux de mauvaise qualité pour faire des toits, comme le bambou et le chaume. Une moustiquaire, roulée sous le matelas, assurera une protection dans ces situations, quand l'insecte adulte peut venir du haut vers le bas, mais une larve d’une des cinq étapes nymphales (les instars) est capable de ramper du plancher vers le haut.
Même lorsque les colonies d’insectes sont éradiquées d'une maison et des abris environnants pour les animaux domestiques, elles peuvent revenir (par exemple, en volant) à partir des plantes ou des animaux qui font partie du cycle antique d'infection sylvestre naturelle. Ceci peut se produire particulièrement dans les zones de savane ouverte intercalées entre des bosquets d’arbres et des habitations humaines.
La végétation dense, comme dans une forêt tropicale, et les habitats urbains, n’offre pas des conditions idéales pour l'établissement du cycle de transmission humaine. Cependant, dans les régions où l’habitat forestier et sa faune est grignoté par l'exploitation économique et l'extension de l’habitat humain, comme dans les zones nouvellement déforestées, piassava palm, (Leopoldinia piassaba) les zones cultivées et certaines parties de l’Amazonie, la maladie peut réapparaître , quand les insectes recherchent une nouvelle proie.[12]
 Cet enfant de Panama souffre de la maladie de Chagas se maifestant comme une affection aigue avec le gonflement de l'oeil droit (signe de Romaña). Source : CDC.
Cet enfant de Panama souffre de la maladie de Chagas se maifestant comme une affection aigue avec le gonflement de l'oeil droit (signe de Romaña). Source : CDC.
Manifestations cliniques
La maladie humaine se développe en deux phases : la phase aiguë peu de temps après l’infection, et la phase chronique qui peut s’étendre sur une durée de 10 ans.
Dans la phase aiguë, un nodule cutané isolé appelé un chagoma peut apparaître au point d’inoculation. Quand ce point de piqûre est conjonctival et muqueux, le patient peut développer une conjonctivite unilatérale et un œdème périorbitaire, ainsi qu’une lymphadénite préauriculaire. Cette constellation de symptômes est désignée par le terme de signe de Romaña . La phase aiguë est habituellement asymptomatique, mais peut présenter des manifestations à type de fièvre, anorexie, lymphadénopathie, légère hépatosplénomégalie, et myocardite. Certains cas aigus (10 à 20%) s’atténuent en 2 à 3 mois pour faire place à une phase chronique asymptomatique et réapparaître après plusieurs années seulement.
La phase chronique symptomatique peut ne pas se produire avant des années ou même des décennies après l'infection initiale. La maladie affecte le système nerveux, le système digestif et le cœur. L’infection chronique entraîne divers troubles neurologiques, allant jusqu’à la démence, une atteinte du muscle cardiaque (la cardiomyopathie qui est la complication la plus sérieuse), et parfois une dilatation du tube digestif (mégacolon et mégaoesophage), ainsi qu’une perte de poids. Des troubles de déglutition peuvent être au premier rang des symptômes digestifs et peuvent conduire à une malnutrition. Après plusieurs années de phase asymptomatique, 27% des sujets infectés présentent des lésions cardiaques, 6% des troubles digestifs, et 3% une atteinte nerveuse périphérique. En l’absence de traitement, la maladie de Chagas peut s’avérer mortelle, dans la plupart des cas en raison d’une cardiomyopathie associée.
Cycle parasitaire
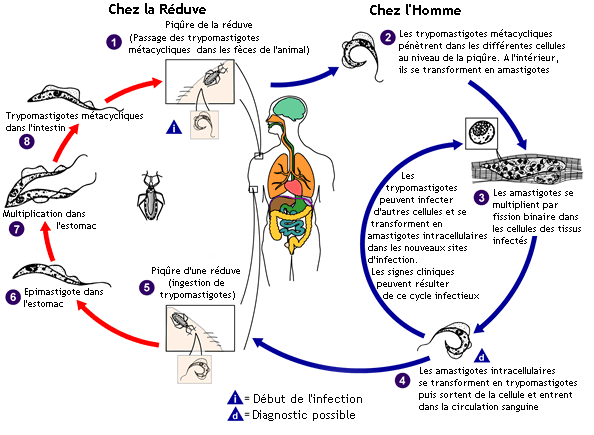
Trypanosoma cruzi fait partie du même genre que l'agent infectieux responsable de la maladie du sommeil africaine, mais ses manifestations cliniques, sa répartition géographique, son cycle de vie et son insecte vecteur sont tout à fait différents. Un insecte vecteur infecté du genre triatomine se nourrit du sang d’un mammifère et libère des trypomastigotes dans ses déjections près du point de piqûre. La victime, en grattant l'emplacement de la plaie, fait pénétrer des trypomastigotes dans l’hôte par la blessure, ou par des muqueuses saines, telles que la conjonctive. Puis, à l'intérieur de l’hôte, les trypomastigotes envahissent les cellules, où ils se transforment en amastigotes intracellulaires. Les amastigotes se divisent par scissiparité et se métamorphosent en trypomastigotes, puis sont libérés dans la circulation comme trypomastigotes circulants. Ces trypomastigotes infectent des cellules d'un type particulier et se transforment en amastigotes intracellulaires dans de nouveaux sites d'infection. Des manifestations cliniques et la mort des cellules des tissus cible peuvent se produire en raison de ce cycle infectieux. Par exemple, il a été montré par l’anatomopathologiste Autrichien et Brésilien le Dr Fritz Köberle dans les années 50 à l’école de Médecine de l'université de São Paulo à Ribeirão Preto, au Brésil, que les amastigotes intracellulaires détruisent les neurones intra-muraux du système nerveux autonome de l'intestin et du cœur, ce qui conduit respectivement au mégacôlon et à l’anévrysme.
Les trypomastigotes circulants ne peuvent pas se diviser (contrairement de ceux du trypanosome africain. La multiplication du parasite reprend seulement quand il envahit une autre cellule ou est ingéré par un autre vecteur. Le kissing bug s’infecte en se nourrissant de sang humain ou animal qui contient des parasites en circulation. D'ailleurs les insectes pourraient répandre l'infection entre eux par leur comportement prédateur et cannibale. Les trypomastigotes ingérés se transforment en épimastigotes dans l’intestin du vecteur. Les parasites se multiplient et se différencient dans l’intestin et deviennent des trypomastigotes métacycliques infectieux dans l’intestin de l’insecte.
Trypanosoma cruzi peut également être transmis à par des transfusions sanguines, des organes transplantés, ou par voie transplacentaire, et le lait maternel, ainsi que[13] dans des accidents de laboratoire. Selon l’organisation mondiale de la santé, le taux d'infection dans les banques de sang d’Amérique latine varie entre 3% et 53%, soit un niveau plus élevé que pour l'infection à HIV et l’hépatite B et C.[3]
Les enfants peuvent également contracter la maladie de Chagas in-utéro,(pendant la grossesse). La maladie de Chagas explique environ 13% des cas de mortalité périnatale dans certaines régions du Brésil. On recommande femmes enceintes de se faire dépister pour la maladie.[14]
Mécanismes de transmission accessoires
Les chercheurs soupçonnaient depuis 1991 que la transmission du trypanosome était possible par voie orale, [15] en raison d'un certain nombre de micro-épidémies limitées à des périodes et à des endroits particuliers (tels qu'une ferme ou un logement familial), en particulier dans des secteurs non-endémiques tels que l’Amazonie (17 épisodes de ce type ont été enregistrés entre 1968 et 1997). En 1991, des ouvriers agricoles de l'État de Paraíba, au Brésil, ont été apparemment infectés par la consommation de nourriture contaminée par des déjections d’opossum ; et en 1997 à Macapá, dans l'État d’Amapá, 17 membres de deux familles ont été probablement infectés en buvant du jus de fruit de palmier Euterpe oleracea contaminé par des insectes vecteurs écrasés de type triatomine.[16]
Au début de l’année 2005, une nouvelle épidémie avec 27 cas a été signalée dans l’Amapá.
En mars 2005, une nouvelle manifestation spectaculaire a été enregistrée dans l'État de Santa Catarina, au Brésil, qui a semblé confirmer ce mécanisme alternatif de transmission. Plusieurs personnes de Santa Catarina qui avaient ingéré du jus de canne à sucre (garapa, en Portugais) dans un kiosque au bord de la route ont contracté la maladie de Chagas.[17]
En 30 mars 2005, 49 cas avaient été confirmés à Santa Catarina, dont 6 décès.
Le mécanisme présumé, jusqu’à présent, est que des insectes porteurs du trypanosome ont été écrasés dans la matière première. Les services d'hygiène de Santa Catarina ont estimé que 60 000 personnes pouvaient avoir été en contact avec la nourriture contaminée à Santa Catarina et ont invité toutes les personnes concernées à se soumettre à des analyses de sang. Ils ont interdit la vente du jus de sucre de canne dans l'État jusqu'à ce que le risque soit circonscrit.
La gravité inhabituelle de cette épidémie a été attribuée à une hypothétique charge parasitaire particulièrement élevée qui aurait été à l’origine de cette infection transmise par voie orale. Les chercheurs brésiliens de l’Institut Oswaldo Cruz, à Rio de Janeiro, étaient capables d’infecter des souris par voie digestive avec des préparations infectées par le trypanosome.
Diagnostic de laboratoire
La mise en évidence de l'agent causal est la procédure de diagnostic utilisée dans la phase aiguë de la maladie de Chagas. Elle donne presque toujours des résultats positifs, et peut être réalisée par :
- Examen au microscope :
a) De sang frais prélevé sur anticoagulant ou culot globulaire, pour les parasites mobiles ;
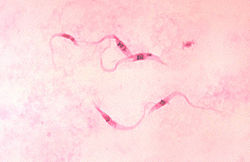
b) Un étalement de sang contaminé sur lame fixé au colorant de Giemsa, pour la visualisation du parasite ; il peut être confondu avec Trypanosoma rangeli , 50% plus long qui n'est pas considéré comme pathogène pour l'homme.
- Isolement de l'agent par :
a) Inoculation à la souris;
b) Culture sur milieu spécial (par exemple, NNN, LIT) etc ..)
c) Xénodiagnostic, un test au cours duquel les Réduves, des insectes non infectés sont nourries par le sang du patient, et le contenu de leur intestin est testé pour une recherche de parasites pendant les 4 semaines qui suivent.
- Tests variés de diagnostic immunologique; (en essayant également de distinguer les souches de (zymodemes) des T.cruzi qui ont une pathogénicité différente).
- Fixation du complément.
- Hémagglutination indirecte.
- Analyse en immunofluorescence indirecte.
- Analyse en radioimmunologie.
- Analyse ELISA (titrage immunoenzymatique utilisant un antigène absorbé).
- Diagnostic par des techniques de biologie moléculaire.
- PCR, réaction en chaîne de polymérase, la technique la plus prometteuse
Pronostic
Un indice pour l'évaluation du pronostic des patients qui ont la maladie de Chagas a été publié dans l'édition du 24 août 2006 du New England Journal of Medicine. [18]
Basé sur l'étude de plus de 500 patients, cet indice inclut des aspects cliniques, radiographique, électrocardiographiques, échocardiographique et des résultats d’enregistrement Holter et permet d'évaluer le pronostic de survie à dix ans des patients.
Facteurs de risques dans la maladie de Chagas Facteur de risques points classe NYHA III ou IV 5 Cardiomégalie 5 Anomalies de mobilité de la paroi 3 Tachycardie ventriculairenon-soutenue 3 Bas voltage de l’ ECG 2 Sexe masculin 2 Nombre total de points Risque de mort dans les 10 ans 0-6 10% 7-11 40% 12-20 85% Traitement
Les médicaments utilisés pour traiter la maladie de Chagas sont habituellement efficaces seulement s’ils sont administrés pendant la phase aiguë de l'infection. Les molécules de choix sont l’azole ou les dérivés nitrés comme le benznidazole[19] ou le nifurtimox ( un nouveau protocole thérapeutique est en cours d'investigation par le service pharmacologique du CDC), mais des résistances à ces molécules ont déjà été rapportées. [20]
En outre, ces substances sont très toxiques et ont de nombreux effets secondaires, et ne peuvent pas être administrés sans surveillance médicale. L'agent antifongique nommé amphotéricine B a été proposé comme traitement de deuxième intention, mais le coût et la toxicité relativement élevée de cette molécule ont limité son utilisation. D'ailleurs, une étude sur l'administration prolongée de drogues pendant dix ans au Brésil a indiqué que la chimiothérapie courante ne supprimait pas totalement la parasitémie. [21]
Ainsi, la décision d’administrer une thérapie antiparasitaire devrait être individualisée après consultation avec un spécialiste.
Dans la phase chronique, le traitement a pour but de contrôler les manifestations cliniques de la maladie, par exemple, drogues pour stimuler le cœur, pour éviter la défaillance cardiaque et les troubles du rythme; traitement chirurgical pour le mégacôlon, etc., mais la maladie elle même n'est pas curable dans cette phase. Les manifestations cardiaques chroniques provoquées par la maladie de Chagas sont maintenant une indication courante de transplantation cardiaque. Jusqu’à récemment, cependant, la maladie de Chagas était considérée comme une contrindication à la transplantation, puisque les lésions cardiaques pouvaient récidiver lorsque le parasite saisirait pour se développer l'opportunité fournie par le traitement immunosuppresseur qui suit l’intervention chirurgicale. La recherche qui a changé l’indication de la transplantation pour les patients atteints de la maladie de Chagas a été conduite par l’équipe du Dr. Adib Jatene à l’institut du cœur de l'université de São Paulo, à São Paulo, au Brésil. [22]
La recherche a montré que les taux de survie chez les patients atteints de maladie de Chagas pouvaient être sensiblement améliorés en utilisant des doses plus faibles d'immunosuppresseur ciclosporine. Récemment, la transplantation de moelle osseuse et l’injection dans le muscle cardiaque de cellules souches s’est montrée efficace pour réduire nettement les risques d'arrêt cardiaque chez les patients atteints de Chagas. [23]
Des patients ont également tiré des bénéfices de la prévention stricte de la réinfection, bien que la raison de ce phénomène ne soit pas encore clairement élucidée.
Quelques exemples de la lutte pour des avancées thérapeutiques :
- L’utilisation des inhibiteurs de l’oxidosqualene cyclase et des inhibiteurs de la cystéine protéase s'est avérée efficace pour traiter les infections expérimentales chez les animaux. [24]
- Les Dermaseptines provenant d’une grenouille de l’espèce Phyllomedusa oreades et P. distincta. Activité Anti- Trypanosoma cruzi sans cytotoxicité pour les cellules de mammifères. [25]
- Synthèse d’inhibiteurs des enzymes impliqués dans le métabolisme de la trypanothione qui est propre au groupe des parasites flagellés. [26]
- Le dehydroleucodine sesquiterpène lactone (DhL) affecte la croissance des cultures d’epimastigotes de Trypanosoma cruzi . [27]
Des protéines qui sont produites par la maladie mais pas par des humains ont été identifiées comme cibles possibles pour des médicaments contre la maladie. [29]
Prévention
Un vaccin suffisamment efficace a été développé à Ribeirão Preto dans les années 70, en utilisant des fractions cellulaires et sous-cellulaires du parasite, mais il a été impossible à commercialiser pour des raisons économiques. Plus récemment, des vaccins potentiels par ADN recombinant pour l’immunothérapie de la maladie de Chagas aiguë et chronique ont été étudiés par plusieurs groupes de recherche.
La prévention est basée sur la lutte contre le vecteur ( Triatoma ) en utilisant des aérosols et des peintures contenant des insecticides (pyrèthrinoïdes de synthèse), et en améliorant le logement et les conditions sanitaires dans les zones rurales. Pour les habitants des villes, il peut être dangereux de passer des vacances et de camper en plein air, dans les zones désertiques ou de dormir dans des hôtels ou des maisons en pisé dans des zones d’endémie, une moustiquaire est recommandée. Si le voyageur a l'intention de voyager dans une zone à risque il devrait pouvoir obtenir une information sur les zones d’endémie de la maladie de Chagas dans des bulletins de renseignements pour les voyageurs, tels que les CDC.
Dans la plupart des pays où la maladie de Chagas est endémique, les tests sanguins sont déjà obligatoires pour les donneurs de sang, puisque la transfusion peut être une voie importante de transmission.
Dans le passé, le sang des donneurs était mélangé à 0.25 g/l de violet de gentiane pour mettre en évidence les parasites.
Avec toutes ces mesures, quelques résultats ont été atteints dans le combat contre la maladie de Chagas en Amérique latine : une réduction de 72% de l'incidence de l'infection humaine chez les enfants et de jeunes adultes des pays de l'initiative du cône méridional, et au moins deux pays (l’Uruguay, en 1997, et le Chili, en 1999), ont été déclarés exempts de toute transmission par un vecteur et par transfusion. Au Brésil, où vit la plus grande partie de la population exposée au risque, 10 états sur les 12 au stade endémique ont été également déclarés exempts de la maladie.
Quelques points de repères pour le contrôle du vecteur :
- Un piège à levure a été testé pour surveiller les infestations par certaines espèces d’insectes : « Efficacité des pièges à levure avec Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata, et Panstrongylus megistus dans des essais en laboratoire. "[30]
- Des résultats prometteurs ont été obtenus avec le traitement des habitats du vecteur avec le champignon Beauveria bassiana, (qui est également en cours d’évaluation pour la prévention de la malaria) : « Activité d’une préparation d’huile de Beauveria bassiana contre le Triatoma sordida dans des zones peridomestiques au centre du Brésil. » [31]
Voir également
- Maladie tropicale
- Initiative pour le traitement des maladies négligées
Notes
- ↑ a et b Chagas C, « Neue Trypanosomen », dans Vorläufige Mitteilung. Arch. Schiff. Tropenhyg., vol. 13, 1909, p. 120-122
- ↑ a et b Redhead SA, Cushion MT, Frenkel JK, Stringer JR, « Pneumocystis and Trypanosoma cruzi: nomenclature and typifications », dans J Eukaryot Microbiol, vol. 53, no 1, 2006, p. 2-11
- ↑ a , b , c et d WHO. Chagas. Accessed 24 September 2006.
- ↑ Historical Aspects of American Trypanosomiasis (Chagas' Disease) by Matthias Perleth
- ↑ Chagas C, « Nova tripanozomiase humana: Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem », dans Mem Inst Oswaldo Cruz, vol. 1, no 2, 1909, p. 159-218 (New human trypanosomiasis. Studies about the morphology and life-cycle of Schizotripanum cruzi, etiological agent of a new morbid entity of man
- ↑ Adler D, « Darwin's Illness », dans Isr J Med Sci, vol. 25, no 4, 1989, p. 218-21
- ↑ Carlier, Yves. Chagas Disease (American Trypanosomiasis). eMedicine (27 February 2003).
- ↑ Kirchhoff LV. "American trypanosomiasis (Chagas disease) --a tropical disease now in the United States." N Engl J Med. 1993 Aug 26;329(9):639-44. PMID 8341339 Online.
- ↑ Karsten V, Davis C, Kuhn R. "Trypanosoma cruzi in wild raccoons and opossums in North Carolina." J Parasitol. 1992 Jun;78(3):547-9. PMID 1597808
- ↑ Centers for Disease Control (CDC). American Trypanosomyasis Fact Sheet. Accessed 24 September 2006.
- ↑ Grijalva MJ, Palomeque-Rodriguez FS, Costales JA, et al. "High household infestation rates by synanthropic vectors of Chagas disease in southern Ecuador." J Med Entomol. 2005 Jan;42(1):68-74. PMID 15691011
- ↑ Teixeira AR, Monteiro PS, Rebelo JM, et al. "Emerging Chagas Disease: Trophic Network and Cycle of Transmission of Trypanosoma cruzi from Palm Trees in the Amazon." Emerg Infect Dis. 2001 Jan-Feb;7(1):100-12. PMID 11266300. PDF full text.
- ↑ Santos Ferreira C, Amato Neto V, Gakiya E, et al. "Microwave treatment of human milk to prevent transmission of Chagas disease." Rev Inst Med Trop São Paulo. 2003 Jan-Feb;45(1):41-2. PMID 12751321
- ↑ Hudson, L; Turner, M.J. “Immunological Conséquences of Infection and Vaccination in South American Trypanosomiasis [and Discussion].” Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, Vol. 307, No. 1131, Towards the Immunological Control of Human Protozoal Diseases. (13 nov. 1984), pp. 51-61. JSTOR. Accessed 2/22/07. Abstract
- ↑ Shikanai-Yasuda MA, Marcondes CB, Guedes LA, et al. "Possible oral transmission of acute Chagas disease in Brazil." Rev Inst Med Trop São Paulo. 1991 Sep-Oct;33(5):351-7. PMID 1844961
- ↑ da Silva Valente S, de Costa Valente V, Neto H. "Considerations on the epidemiology and transmission of Chagas disease in the Brazilian Amazon." Mem Inst Oswaldo Cruz 94 Suppl 1: 395-8. PMID 10677763
- ↑ UK Health Protection Agency (HPA). Chagas’ disease (American trypanosomiasis) in southern Brazil. Accessed 24 September 2006.
- ↑ Rassi A Jr, Rassi A, Little W, Xavier S, Rassi S, Rassi A, Rassi G, Hasslocher-Moreno A, Sousa A, Scanavacca M, « Development and validation of a risk score for predicting death in Chagas' heart disease », dans N Engl J Med, vol. 355, no 8, 2006, p. 799–808
- ↑ Garcia S, Ramos CO, Senra JF, et al. "Treatment with benznidazole during the chronic phase of experimental Chagas disease decreases cardiac alterations." Antimicrob Agents Chemother. 2005 Apr;49(4):1521-8. PMID 15793134 Online
- ↑ Buckner FS, Wilson AJ, White TC, Van Voorhis WC. "Induction of resistance to azole drugs in Trypanosoma cruzi." Antimicrob Agents Chemother. 1998 Dec;42(12):3245-50. PMID 9835521 Online
- ↑ Lauria-Pires L, Braga MS, Vexenat AC, et al. "Progressive chronic Chagas heart disease ten years after treatment with anti-Trypanosoma cruzi nitroderivatives." Am J Trop Med Hyg. 2000 Sep-Oct;63(3-4):111-8. PMID 11388500 PDF Full text
- ↑ Bocchi EA, Bellotti G, Mocelin AO, Uip D, et al. "Heart transplantation for chronic Chagas' heart disease." Ann Thorac Surg. 1996 Jun;61(6):1727-33. PMID 8651775Online
- ↑ Vilas-Boas F, Feitosa GS, Soares MB, Mota A, et al. "[Early results of bone marrow cell transplantation to the myocardium of patients with heart failure due to Chagas disease]." Arq Bras Cardiol. 2006 Aug;87(2):159-66. PMID 16951834 PDF Full text. Also available here.
- ↑ Engel JC, Doyle PS, Hsieh I, McKerrow JH. "Cysteine protease inhibitors cure an experimental Trypanosoma cruzi infection." J Exp Med. 1998 Aug 17;188(4):725-34. PMID 9705954Online.
- ↑ PMID 12379643
- ↑ Fairlamb AH, Cerami A. "Metabolism and functions of trypanothione in the Kinetoplastida." Annu Rev Microbiol. 1992;46:695-729. PMID 1444271
- ↑ Brengio SD, Belmonte SA, Guerreiro E, et al. "The sesquiterpene lactone dehydroleucodine (DhL) affects the growth of cultured epimastigotes of Trypanosoma cruzi." J Parasitol. 2000 Apr;86(2):407-12. PMID 10780563
- ↑ El-Sayed NM, Myler PJ, Bartholomeu DC, et al. (2005). "The genome sequence of Trypanosoma cruzi, etiologic agent of Chagas disease". Science 309 (5733): 409-15. PMID 16020725
- ↑ El-Sayed, et al., 2005
- ↑ Pires HH, Lazzari CR, Diotaiuti L, Lorenzo MG. "Performance of yeast-baited traps with Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata, and Panstrongylus megistus in laboratory assays." Rev Panam Salud Publica. 2000 Jun;7(6):384-8. PMID 10949899
- ↑ Luz C, Rocha LF, Nery GV, Magalhaes BP, Tigano MS. "Activity of oil-formulated Beauveria bassiana against Triatoma sordida in peridomestic areas in Central Brazil." Mem Inst Oswaldo Cruz. 2004 Mar;99(2):211-8. PMID 15250478 Online.
- ↑ PubMed Search on Triatominae symbiosis
Sources
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Chagas disease ».
References
- CDC, Division of Parasitic Diseases. Chagas Disease Fact Sheet. (23 September 2004). Accessed 24 September 2006.
- Dumonteil E, Escobedo-Ortegon J, Reyes-Rodriguez N, Arjona-Torres A, Ramirez-Sierra M, « Immunotherapy of Trypanosoma cruzi infection with DNA vaccines in mice. », dans Infect Immun, vol. 72, no 1, 2004, p. 46-53
Autres lectures
- Coutinho M, « Ninety years of Chagas disease: a success story at the periphery. », dans Soc Stud Sci, vol. 29, no 4, 1999, p. 519-49
- Dias J, Silveira A, Schofield C, « The impact of Chagas disease control in Latin America: a review. », dans Mem Inst Oswaldo Cruz, vol. 97, no 5, 2002, p. 603-12 [texte intégral]
- Kropf S, Azevedo N, Ferreira L, « Biomedical research and public health in Brazil: the case of Chagas' disease (1909-50). », dans Soc Hist Med, vol. 16, no 1, 2003, p. 111-29
- « International Symposium to commemorate the 90th anniversary of the discovery of Chagas disease (Rio de Janeiro, April 11-16, 1999) », dans Memorias do Instituto Oswaldo Cruz, vol. 94, no Suppl. I, 1999 [texte intégral]
- Moncayo A, « Progress towards interruption of transmission of Chagas disease. », dans Mem Inst Oswaldo Cruz, vol. 94 Suppl 1, p. 401-4 [texte intégral]
- Prata A, « Evolution of the clinical and epidemiological knowledge about Chagas disease 90 years after its discovery. », dans Mem Inst Oswaldo Cruz, vol. 94 Suppl 1, p. 81-8 [texte intégral]
- (en) World Class Parasites. Volume 7: American Trypanosomiasis, Kluwer Academic Publishers Amazon review
Liens externes
- VCU Virtual Parasite Project
- All About Chagas Disease , Chagas Information & Prevention, Identification, also in Spanish.
- Chagaspace , also in Spanish.
- ChagMex: Database on-line. UNAM-Instituto de Biología.
- Chagas Disease. PanAmerican Health Organization.
- Chagas disease. The UNDP-Unicef-WHO-World Bank Special Programme of Research (TDR).
- Disease Information. American Trypanosomiasis or Chagas Disease. Travel Medicine Program. Health Canada.
- Links to Chagas Disease pictures (Hardin MD/Univ of Iowa)
- Link to "The Kiss of Death". An anthropological view of Chagas disease (Joseph Bastien/Univ of Texas at Arlington).
- Lutte microbiologique dans la maladie de Chagas - Hyphomycètes contre vecteurs Film réalisé par Hervé Lièvre, production SFRS (CERIMES) - vidéo en ligne, 1990, 23 minutes.
Informations et événements récents
- Chagas Control in the Southern Cone Countries: History of an International Initiative, 1991/2001, PAHO. (Full text e-book)
- Genome Sequencing Project
- Parasites' genetic code 'cracked' From BBC
- Catholic Relief Services. Housing Improvement and Chagas Disease Prevention Project
- 2006: Nature.com / Scott M. Landfear: Flagella are whip-like structures that power the movement of certain cells. Analysis of a single-cell parasite, the African trypanosome, reveals that flagella are also essential for viability in this organism. (restricted commercial access now)
- Science Magazine Search Results: Chagas
- Portail de la médecine
Catégories : Infection parasitaire | Maladie tropicale | Maladie infectieuse tropicale
Wikimedia Foundation. 2010.