- Peroxyde d'azote
-
Peroxyde d'azote 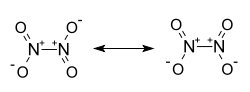
Structure du peroxyde d'azote.Général Nom IUPAC Tétraoxyde d'azote No CAS No EINECS No RTECS PubChem ChEBI SMILES InChI Apparence liquide incolore Propriétés chimiques Formule brute N2O4 [Isomères] Masse molaire[1] 92,011 ± 0,0016 g·mol-1
N 30,45 %, O 69,55 %,Propriétés physiques T° fusion -9,3 °C [2] T° ébullition 21,15 °C [2] Solubilité réagit avec l'eau Masse volumique 1,45 g·cm-3 à 20 °C [2] Point critique 431 K; 10,1 MPa; 167 cm3·mol-1 [2] Thermochimie ΔvapH° 38,12 kJ·mol-1 (1 atm, 21,15 °C)[3] Précautions Directive 67/548/EEC[4] 
T+
OPhrases R : 8, 26, 34, Phrases S : 1/2, 9, 26, 28, 36/37/39, 45, Transport 265 1067 SIMDUT[5] Produit non classifié SGH[6],[7] 



DangerUnités du SI & CNTP, sauf indication contraire. Le peroxyde d'azote, ou tétraoxyde de diazote, est un composé chimique de formule N2O4. C'est un liquide incolore à jaune brun selon la concentration de dioxyde d'azote NO2 qu'il contient : N2O4 est en équilibre avec NO2, dont il constitue en fait un dimère. C'est un oxydant très puissant, corrosif et toxique. Appelé également NTO en astronautique, le peroxyde d'azote est un comburant très employé notamment avec l'hydrazine et ses dérivés pour former des propergols liquides stockables hypergoliques.
Sommaire
Propriétés et structure
La structure de cette molécule a été très discutée jusqu'à la fin des années 1940, où on a commencé à la comprendre[8], tout comme celle du trioxyde d'azote [9]. La molécule N2O4 est plane, avec une liaison N-N de 178 pm et une liaison N-O de 119 pm. Contrairement à la molécule NO2, le dimère N2O4 est diamagnétique[10],[11]. Dans les années 1940 également on a montré que sour forme liquide, à la différence de l'ammoniac ou du dioxyde de soufre, ce milieu n'était pas propice aux réactions inorganiques qui étaient initialement supposées possible par l'ionisation du milieu. On n'a pas trouvé à l'époque de sels minéraux solubles dans ce liquide, et compte tenu de la solubilité élevée de nombreux composés organiques, les chimistes ont alors conclu que ce liquide avait un caractère non-ionisant et un comportement évoquant celui de solvants organiques tels que le benzène[12].
En condition normale de température et de pression, et en vertu de l'équilibre entre peroxyde d'azote et dioxyde d'azote, les deux espèces sont toujours présentes simultanément, l'augmentation de température déplaçant l'équilibre de cette réaction endothermique vers le dioxyde par dissociation du dimère :
Préparation
Le peroxyde d'azote est produit par oxydation catalysée de l'ammoniac NH3 dans de la vapeur d'eau pour limiter la température, ce qui permet d'oxyder le monoxyde d'azote N≡O en dioxyde d'azote NO2 tandis que l'eau est évacuée sous forme d'acide nitrique HNO3 ; le gaz résiduel est composé essentiellement de peroxyde d'azote, qu'il suffit alors de refroidir.
Utilisation astronautique
Le peroxyde d'azote est l'un des principaux ergols utilisés aujourd'hui en propulsion spatiale. Il a remplacé l'acide nitrique d'abord utilisé comme comburant des propergols de moteurs-fusée, avec des carburants tels que RP-1, UDMH ou MMH. Les moteurs étaient protégé de l'acidité du comburant par un ajout de 0,6 % de fluorure d'hydrogène HF, plutôt cher, très toxique et de manipulation dangereuse. L'acide nitrique a été remplacé par d'autres comburants, notamment le peroxyde d'azote, dès le début des années 1990. Les lanceurs spatiaux et les missiles ballistiques ont commencé à l'utiliser vers la fin des années 1950, lorsque les États-Unis et l'URSS l'ont choisi comme comburant formant avec l'hydrazine et ses dérivés[13] des propergols liquides stockables hypergoliques. Appelé NTO (pour Nitrogen Tetroxide) dans le cadre de la propulsion spatiale, le peroxyde d'azote est aujourd'hui utilisé par le lanceur russe Proton, la fusée chinoise Longue Marche, le système de manœuvre orbital (OMS) de la navette spatiale de la NASA, l'étage à propergol stockable (EPS) d'Ariane 5, ou encore le lanceur indien GSLV.
Lorsqu'il est utilisé comme ergol oxydant, le peroxyde d'azote est généralement mélangé à un faible pourcentage de monoxyde d'azote N≡O pour en limiter les effets corrosifs sur les alliages de titane intervenant dans le système de propulsion des engins spatiaux : c'est ce qu'on appelle le MON (pour Mixed Oxides of Nitrogen) ; l'OMS de la navette spatiale utilise par exemple du MON-3, à 3 % de N≡O (fraction pondérale).
Synthèse
Lors de la combustion Nitrate de cuivre + Nitrate de plomb (II), du Dioxyde d'azote et du Peroxyde d'azote apparaissent.
Toxicité, écotoxicité
La toxicité du peroxyde d'azote inhalée est avérée et a été étudiée chez l'animal de laboratoire.
Elle découle de son caractère oxydant, qui a des effets directs sur les cellules, mais aussi d'effets de perturbation endocrinienne. Des chercheurs militaires chinois ont montré que le peroxyde d'azote affecte notamment certains facteurs produits par l'oreillette droite du cœur[14], (facteurs hormonaux qui régulent la tension). Ces mêmes chercheurs ont montré que d'autres facteurs de régulation (dits natriurétiques), des polypeptides (« Atrial natriuretic polypeptide » ou « ANP ») produits par les poumons, et présent dans le mucus pulmonaire étaient également perturbés[15].Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Nitrogen Tetroxide » dans la base de données Hazardous Substances Data Bank, consulté le 11 juin 2010
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0)
- « Dinitrogen tetraoxide » sur ESIS, consulté le 11 juin 2010
- « Tétroxyde d’azote » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- SIGMA-ALDRICH
- J. S. BROADLEY & J. MONTEATH ROBERTSON Structure of Dinitrogen Tetroxide nature 164, 915-915 1949/11/26 ; doi:10.1038/164915a0
- C. K. INGOLD & E. HILDA INGOLD [Constitutions of Dinitrogen Tetroxide and Trioxide] Nature 159, 743-744 ; Date 1947/05/31 ; doi:10.1038/159743b0
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press, 2001, San Diego. ISBN 978-0-12-352651-9.
- W. ROGIE ANGUS , RICHARD W. JONES & GLYN O. PHILLIPS Existence of Nitrosyl Ions (NO+) in Dinitrogen Tetroxide and of Nitronium Ions (NO2 +) in Liquid Dinitrogen Pentoxidenature 164, 433-434 (1949/11/10) ; doi:10.1038/164433aZ
- C. C. ADDISON & R. THOMPSON Ionic Reactions in Liquid Dinitrogen Tetroxide ; nature 162, 369-370 (1948/11/04) ; doi:10.1038/162369a0
- Hydrate d'hydrazine, MMH, UDMH, Aérozine 50 et UH 25 principalement
- YE Ming Liang, XIA Ya Dong, WEN Si Zhen, GUO Xu Yi ; [Change in atrial natriuretic factor content in rats suffered from acute pulmonary edema induced by dinitrogen tetroxide] ; (Institute of Pharmacology and Toxicology, Academy f Military Medical Sciences, Beijing 100850) (Accès à l'article, en chinois)
- [Effect of dinitrogen tetroxide on atrial natriuretic polypeptide and lung surfactant in rats Ye Mingliang] *,Wu Haihuan,Peng Liyi,et al. ; Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850 (Lien vers l'article original (chinois), résumé
Articles connexes
Liens et documents externes
Wikimedia Foundation. 2010.




 2
2