- PH physiologique
-
Potentiel hydrogène
 Pour les articles homonymes, voir PH.
Pour les articles homonymes, voir PH.Le pH en phase aqueuse au quotidien : Substance pH approximatif Acide chlorhydrique molaire 0 Drainage minier acide (DMA) <1,0 Acide d'un accumulateurs ou batterie <1,0 Acide gastrique 2,0 Jus de citron 2,4 - 2,6 Cola[1] 2,5 Vinaigre 2,5 - 2,9 Jus d’orange ou de pomme 3,5 Bière 4,5 Café 5,0 Thé 5,5 Pluie acide < 5,6 Lait 6,5 Eau pure 7,0 Salive humaine 6,5 – 7,4 Sang 7,34 – 7,45 Eau de mer 8,0 Savon 9,0 à 10,0 Ammoniaque 11,5 Chaux 12,5 Soude ou potasse molaire 14,0 Le potentiel hydrogène (ou pH) mesure l'activité chimique des ions hydrogènes (H+) (appelés aussi couramment protons[note 1]) en solution. Notamment, en solution aqueuse, ces ions sont présents sous la forme de l'ion oxonium (également, et improprement, appelé ion hydronium). Plus couramment, le pH mesure l’acidité ou la basicité d’une solution. Ainsi, dans un milieu aqueux à 25°C, une solution avec un pH :
- inférieur à 7 est acide ;
- supérieur à 7 est basique ;
- égal à 7 est neutre.
Historique
En 1909, le chimiste danois Søren Sørensen, qui travaille alors sur les effets des concentrations de quelques ions sur des protéines, remarque l’importance des ions hydrogènes et décide d’introduire le concept de pH[2]. Dans l’article où est évoqué le pH pour la première fois, Sørensen utilise la notation pH[3]. Dans cette publication, il donne au sigle la signification en latin Pondus Hydrogenii (« potentiel de l’hydrogène ») ; mais dans les comptes-rendus de travaux qu’il rédige au sein du Carlsberg Laboratory de l’Université de Copenhague la même année, p est l’abréviation du mot allemand potenz (potentiel) et H est le symbole de l’hydrogène[4]. Sørensen définit alors l’acidité d’une solution comme étant le cologarithme décimal de la concentration (exprimée en moles par litre) en ions hydrogène :
![p_H=-\log_{10} \left[ H^+ \right] \,](/pictures/frwiki/49/1ce254da29892235ee1e0a8982ffc5d8.png)
Le principe d’une telle échelle de pH est accepté par la communauté scientifique, notamment grâce au chimiste allemand Leonor Michaelis qui publie en 1914 un livre sur la concentration des ions hydrogène[5]. En 1924, suite à l’introduction du concept d’activité, Sørensen publie un nouvel article précisant que le pH dépend plutôt de l’activité que de la concentration en H+[6] Entretemps, la notation pH a été adoptée, sans que l’on sache vraiment qui en a été l’initiateur :
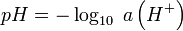
Par la suite, la lettre p est reprise dans plusieurs notations usuelles en chimie, pour désigner le cologarithme : pK, pOH, pCl… La signification du sigle pH a été adaptée par chaque langue. Ainsi, en français, on entendra par pH « potentiel hydrogène »[7],[8], on acceptera « potential hydrogen »[9] en anglais, « potenz hydrogene » en allemand ou encore « potencial hidrógeno » en espagnol.
La notion d’acidité, qui était à la base uniquement qualitative, s’est vue dotée d’un caractère quantitatif avec les apports de la théorie de Bronsted-Lowry et du pH. Alors qu’au début du XXe siècle, on utilisait uniquement des indicateurs de pH pour justifier du caractère acide ou basique d’une solution, les évolutions en électrochimie ont permis à l’IUPAC de se tourner dans les années 1990 vers une nouvelle définition du pH, permettant des mesures plus précises[2].
Définitions
Définition classique
Depuis le milieu du XXe siècle, l’IUPAC reconnaît officiellement la définition de Sørensen du pH[10]. Elle est utilisée dans les programmes scolaires (études supérieures) et les dictionnaires :
où aH (on utilise aussi la notation a(H+) ou encore [H+]) est l’activité des ions hydrogène H+, sans dimension. Le pH est lui-même une grandeur sans dimension.
Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogènes induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul à l’aide de définitions plus ou moins exactes de l’activité.
Loi de Nernst
L’IUPAC donne aujourd’hui une définition du pH à partir d’une méthode électrochimique expérimentale. Elle consiste à utiliser la relation de Nernst dans la cellule électrochimique suivante :
- Électrode de référence | Solution de KCl concentré | Solution X | H2 | Pt (électrode à hydrogène)
À l’aide de mesures de la fem (force électro-motrice) de la cellule avec une solution X et une solution S de référence, on obtient :
avec
- pH(X) : pH de la solution inconnue
- pH(S) : pH tabulé de la solution de référence S
- E(X) : fem de la cellule avec la solution inconnue X
- E(S) : fem de la cellule avec la solution de référence S à la place de la solution X
- F = 96 485 C⋅mol-1 : Constante de Faraday
- R = 8,314472 J⋅mol-1⋅K-1 : Constante universelle des gaz parfaits
- T : température absolue, en kelvin
DémonstrationL’électrode de travail est en fait une électrode à hydrogène (voir #Mesure et indicateurs). On considère le couple H+/H2.
Le potentiel électrochimique de l’électrode de travail est donné par la relation de Nernst :
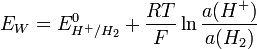
Sachant que le potentiel standard du couple H+/H2 est nul par convention (référence), on obtient :
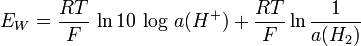
et donc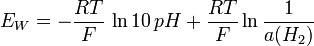
La fem de la cellule électrochimique est :
E = EW − Eref
Distinguons maintenant deux fem, EX pour une solution inconnue, et ES pour une solution connue S. En les soustrayant, on a :
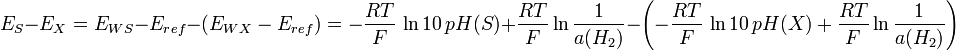
d’où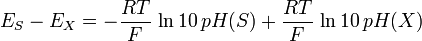
et enfin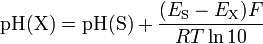
Cette définition du pH a été standardisée par la norme ISO 31-8 en 1992[11].
En solution aqueuse
Définitions approximatives
Les manipulations liées au pH en chimie étant le plus souvent réalisées en milieu aqueux, on peut déterminer plusieurs définitions approchées du pH en solution aqueuse. En utilisant deux définitions différentes de l’activité chimique, on peut écrire les deux relations ci-dessous. Elles sont valables dans le domaine limité des solutions aqueuses de concentrations en ions inférieures à 0 1 mol⋅L-1 et n’étant ni trop acide, ni trop basique, c’est-à-dire pour des pH entre 2 et 12 environ[12].
avec
- γH est le coefficient d’activité des ions H+, sans dimension
- [H+] est la concentration molaire en ions H+, en mol.L-1
- C0 = 1 mol⋅L-1 est la concentration standard
et
avec
- γH est le coefficient d’activité des ions H+, sans dimension
- mH est la molalité des ions H+, en mol.kg-1
- m0 = 1 mol⋅kg-1 est la molalité standard
Pour des concentrations encore plus faibles en ions en solution, on peut assimiler l’activité des ions H+ à leur concentration (le coefficient d’activité tend vers 1). On peut écrire :
Par abus d’écriture, l’écriture n’est pas homogène, La concentration standard C0 étant souvent omise pour simplifier la notation. Cette relation est la plus connue et est la plus utilisée dans l’enseignement secondaire.
Pour des acides forts en solution aqueuse à des concentrations supérieurs à 1 mol⋅kg-1, l'approximation précédente n'est plus valable : il faut se ramener à la définition pH = − log(a(H3O + )) où l'activité des ions oxonium a(H3O + ) tend vers 1 quand la concentration augmente, soit un pH qui tend vers 0 + .
De même pour des bases fortes en solution aqueuse à des concentrations supérieurs à 1 mol⋅kg-1, l'activité des ion hydroxydes HO- tend vers 1 ; or, par définition de Ke, produit ionique de l'eau valant 10 − 14 à 25 °C, on a
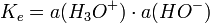 donc a(H3O + ) ne peut être supérieur à Ke, soit un pH qui tend vers 14 quand la concentration en base forte augmente.
donc a(H3O + ) ne peut être supérieur à Ke, soit un pH qui tend vers 14 quand la concentration en base forte augmente.Hydratation des ions H+
Article détaillé : Ion hydronium.Acides et bases
Bronsted et Lowry ont donné une définition simple des concepts d’acide et de base comme étant respectivement un donneur et un accepteur de proton. D’autres conceptions de l’acidité sont utilisées dans les milieux non protiques (milieux où l’espèce échangeable n’est pas le proton), telle la théorie de Lewis :
Théorie Acide Base Domaine d’application Arrhenius donneur de H+ donneur de OH- eau Bronsted donneur de H+ accepteur de H+ solvant protique Lewis accepteur de paire e- donneur de paire e- cas général Exemples :
- OH- est une base d’Arrhenius, Bronsted et Lewis ;
- NH3 est une base de Bronsted et Lewis, mais pas d’Arrhenius ;
- BF3 est un acide de Lewis, mais ni d’Arrhenius, ni de Bronsted.
Autoprotolyse
Le pH varie dans l’intervalle défini grâce à la constante d’auto-protolyse du solvant.
En solution aqueuse, à température et pression standard (CNTP), un pH de 7,0 indique la neutralité car l’eau, amphotère, se dissocie naturellement en ions H+ et OH- aux concentrations de 1,0×10-7 mol⋅L-1. Cette dissociation est appelée autoprotolyse de l’eau :
- l’eau est une base : H2O (l) = H+ (aq) + OH- (aq)
- l’eau est un acide : H2O (l) + H+ (aq) = H3O+ (aq)
- d’où la réaction : H2O (l) + H2O (l) = H3O+ (aq) + OH- (aq)
Dans les conditions normales de température et de pression (TPN), le produit ionique de l’eau ([H+][OH-]) vaut 1,0116 ×10-14, d’où pKe = 13,995. On peut également définir le pOH (-log aOH-), de sorte que pH + pOH = pKe.
Le pH doit être redéfini – à partir de l’équation de Nernst – en cas de changement de conditions de température, de pression ou de solvant.
Influence de la pression et de la température
Le produit ionique de l’eau ([H+][OH-]) varie avec la pression et la température : sous 1 013 hPa et à 24,9 °C (TPN), le produit ionique vaut 1,0116 ×10-14, d’où pKe = 13,995 ; sous 1010 Pa et à 799,9 °C, pKe n’est que de 7,68 : le pH d’une eau neutre est alors de 3,84 ! Sous une atmosphère de 1 013 hPa (pression de vapeur d’eau saturante), on a :
- à 0 °C : pKe = 14,938, d’où le pH de la neutralité = 7,4690 ;
- à 25 °C : pKe = 13,995, d’où le pH de la neutralité = 6,9975 ;
- à 100 °C : pKe = 12,265, d’où le pH de la neutralité = 6,1325.
Le produit ionique de l’eau varie selon l’équation suivante (Marshall et Franck, 1981) :
log Ke* = -4,098 - 3245,2/T + 2,2362 ×105/T2 - 3,984 ×107/T3 + (13,957+1262,3/T + 8,5641 ×105/T2) log de* dans laquelle Ke* = Ke/(mol.kg-1) et de*=de/(g.cm-3) (pression de vapeur).
Influence du solvant
Dans d’autres solvants que l’eau, le pH n’est pas fonction de la dissociation de l’eau. Par exemple, le pH de neutralité de l’acétonitrile est de 27 (TPN) et non de 7,0.
Le pH est défini en solution non aqueuse par rapport à la concentration en protons solvatés et non pas par rapport à la concentration en protons dissociés. En effet, dans certains solvants peu solvatants, le pH d’un acide fort et concentré n’est pas nécessairement faible. D’autre part, selon les propriétés du solvant, l’échelle de pH se trouve décalée par rapport à l’eau. Ainsi, dans l’eau l’acide sulfurique est un acide fort, tandis que dans l’éthanol, c’est un acide faible. Travailler en milieu non aqueux rend le calcul du pH très compliqué.
Acidité et alcalinité
Un pH moins élevé que celui de la neutralité (par exemple 5 pour une solution aqueuse) indique une augmentation de l’acidité, et un pH plus élevé (par exemple 9 pour une solution aqueuse) indique une augmentation de l’alcalinité, c’est-à-dire de la basicité.
Un acide diminuera le pH d’une solution neutre ou basique ; une base augmentera le pH d’une solution acide ou neutre. Lorsque le pH d’une solution est peu sensible aux acides et aux bases, on dit qu’il s’agit d’une solution tampon (de pH) ; c’est le cas du sang, du lait ou de l’eau de mer, qui renferment des couples acido-basiques susceptibles d’amortir les fluctuations du pH, tels anhydride carbonique / hydrogénocarbonate / carbonate, acide phosphorique / hydrogénophosphate / phosphate, acide borique / borate.
Le pH d’une solution dite physiologique est de 7,41.
Activité et concentration
Pour des concentrations ioniques importantes, l’activité ne peut plus être assimilée à la concentration et on doit tenir compte de la force ionique, par exemple grâce à la théorie de Debye-Hückel. Le pH d’une solution décamolaire d’acide fort n’est donc pas égal à -1 comme le pH d’une solution décamolaire de base forte n’est pas égal à 15. L’agressivité de telles solutions et leur force ionique importante rend la mesure du pH délicate avec les habituelles électrodes de verre. On a donc recours à d’autres méthodes s’appuyant sur les indicateurs colorés (spectroscopie UV ou RMN). Pour des concentrations élevées de H+, on peut définir par analogie d’autres échelles de mesure d’acidité, telle l’échelle de Hammett H0.
Mesure et indicateurs
L’activité d’un ion n’étant pas directement mesurable, on mesure la force électromotrice engendrée par une différence de pH, d’où l’utilisation d’une référence. Cette relation suit la loi de Nernst :
![\rm{pH}\left( X \right) = \rm{pH}\left( S \right) + \ln \left(10\right).R.T.F^{-1} \left[ E(S)-E(X) \right]](/pictures/frwiki/57/9452d87cb0ba05f50b9e3e2d48d7882e.png)
dans laquelle X est la solution dont le pH est inconnu et S, la solution de référence ; avec ln(10).R.T.F-1 = 59 159 mV à 298 K (R est la constante des gaz parfaits, T, la température et F, la constante de Faraday).
Généralement, le pH est mesuré par électrochimie avec un pH-mètre, appareil comportant une électrode combinée spéciale, dite électrode de verre, ou deux électrodes séparées. L’électrode de référence est en général au calomel saturé (ECS).
Il existe de nombreuses façons de mesurer l’acidité, on utilise fréquemment des indicateurs de pH.
Formules de calcul approché du pH pour des solutions aqueuses
a 25°C pKe = 14
Cas d'un acide fort
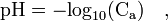 où Ca est la concentration en acide en mol/L
où Ca est la concentration en acide en mol/LCette relation n’est pas valable pour des concentrations inférieures à 1×10-7 mol⋅L-1 et ne devrait s’appliquer qu’avec des concentrations supérieures à 1×10-5 mol⋅L-1. Son application à une solution diluée à 10-8 donne en effet pH = 8, ce qui est absurde puisque la solution est acide et non alcaline (le pH d’une telle solution est de 6,98) ;
Dans le cas d’un monoacide, le pH se calcule en résolvant l’équation du troisième degré suivante : (H+)3 + Ka (H+)2 - (H+) [Ke + Ka C] - Ka.Ke = 0 ;
Dans le cas limite
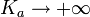 , l’équation précédente devient alors (H + )2 − CaH + − Ke = 0 d’où on déduit que
, l’équation précédente devient alors (H + )2 − CaH + − Ke = 0 d’où on déduit que 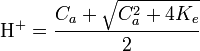 . Lorsque
. Lorsque 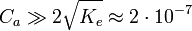 , on a
, on a 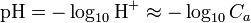 .
.Cas d'une base forte
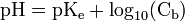 où Cb est la concentration en base en mol.L-1.
où Cb est la concentration en base en mol.L-1.Cette relation est soumise aux mêmes remarques que pour le cas d’un acide fort.
Cas d'un acide faible
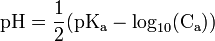 où le pKa est celui de l’acide.
où le pKa est celui de l’acide.Cas d'une base faible
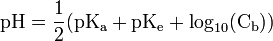 où le pKa est celui de l’acide créé.
où le pKa est celui de l’acide créé.Cas d'un mélange de solutions de pH connus
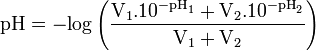
Cette formule est très approximative, notamment si les acides ou bases utilisés sont faibles, et devrait être utilisée avec la plus grande prudence.
pH négatif
En conséquence des formules précédentes, lorsque la concentration est supérieure à 1, ce qui n’a rien d’impossible, le pH devient négatif.
Dans des solutions assez peu concentrées (on dit « solution diluée »), l’acidité est mesurée par la concentration en ions hydronium (oxonium) ou [H3O+], car les ions H+ s’associent avec [H2O]. Cependant, aux fortes concentrations, cet effet est en partie contrebalancé par les coefficients d’activité qui s’effondrent aux concentrations élevées. Néanmoins, il est possible d’obtenir des pH négatifs.
Par exemple, les laboratoires peuvent se procurer un acide chlorydrique [HCl] concentré commercial (37 % en masse) qui fournit un pH d’environ -1,1 ; de même, une solution saturée en NaOH a un pH de 15,0.
Les produits plus acides que l’acide sulfurique à 100 %, sont qualifiés de superacides[13]. Ceux-ci sont couramment utilisés, notamment comme catalyseurs pour l’isomérisation et le craquage des alcanes[14],[15].
pH d'un sol
Article détaillé : Acidification des sols.Le pH d’un sol a une influence sur l’assimilation des nutriments et oligo-éléments par une plante.
Annexes
Bibliographie
- L. Lopes, « Méthode de la réaction prépondérante : proposition d’une approche quantitative systématisée », dans Bulletin de l’union des physiciens, vol. 102, no 904, Mai 2008, p. 707-726 [texte intégral]
Notes
- ↑ Un ion hydrogène est un atome d'hydrogène qui a perdu son unique électron. Or le noyau d’hydrogène n'est constitué que d’un proton. Un ion H+ n'est donc effectivement plus qu'un proton.
Références
- ↑ « L’acidité, le pH » sur le site de l’académie d’Orléans-Tours
- ↑ a et b (en) Søren Sørenson, Chemical Achievers - The Human Face of the Chemical Science, Chemical Heritage Foundation. Consulté le 2007-01-09
- ↑ (de) Søren Peder Lauritz Sørensen, « Enzymstudien. II: Mitteilung. Über die Messung und die Bedeutung der Wasserstoffionenkoncentration bei enzymatischen Prozessen », dans Biochemische Zeitschrift, volume 21, 1909, p. 131-304
- ↑ (en) Comptes rendus des travaux du laboratoire Carlsberg, vol. 8, p. 1, Copenhague, 1909(ISSN 0075-7497)
- ↑ (en) Søren Peter Lauritz Sørensen sur le site [1]
- ↑ (en) Patrick Gormley, « The facts about pH », 2003.
- ↑ « pH » dans le Trésor de la langue française informatisé
- ↑ pH sur Futura-Sciences. Consulté le 10/05/2006
- ↑ pH quiz Study Guide sur http://www.morrisonlabs.com/
- ↑ (en)« Manual of Symbols and Terminology for Physicochemical Quantities and Units », 2e rév., dans Pure Appl. Chem. no 51, p. 1, 1979
- ↑ (en) Organisation internationale de normalisation, ISO Standards Handbook: Quantities and units,ISO, Genève, 1993, (ISBN 92-67-10185-4)
- ↑ (en) Ian Mills, Tomislav Cvitas, Klaus Homann et al., Quantities, Units and Symbols in Physical Chemistry ("Green Book"), Blackwell Science (pour l’IUPAC), 1993, 2e éd. (1er éd. 1988), p. 62, (ISBN 0-632-03583-8), [Green Book de l’IUPAC lire en ligne]
- ↑ R.J. Gillespie. Accounts of Chemical Research, Vol. 1, 1968, p.202.
- ↑ (en) George A. Olah, Schlosberg RH. "Chemistry in Super Acids. I. Hydrogen Exchange and Polycondensation of Methane and Alkanes in FSO3H–SbF5 ("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of CH5+ and Related Hydrocarbon Ions. The High Chemical Reactivity of "Paraffins" in Ionic Solution Reactions". Journal of the American Chemical Society, vol.90 (10) , 1968, p.2726–2727
- ↑ (en) Réponse de Richard Barrans à un étudiant, sur le site "Ask a scientist" :lien
Voir aussi
Articles connexes
Liens externes
- Influence du pH d’un sol sur l’assimilation des éléments nutritifs pour une plante
- pKa de 70 couples acide/base usuels
- Portail de la chimie
Catégories : Chimie générale | Échelle | Propriété chimique | Repère logarithmique
Wikimedia Foundation. 2010.

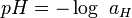
![pH=-\log_{10} \left( \gamma _H \frac{[H^+]}{C_0} \right)](/pictures/frwiki/100/d60ea78b2f7fa4856f8c97fd35f83c17.png)

![pH=-\log_{10} \, [H^+]](/pictures/frwiki/55/79c16ab4e4d46455a9727be2b811a933.png)
