- Ozonosphère
-
Couche d'ozone
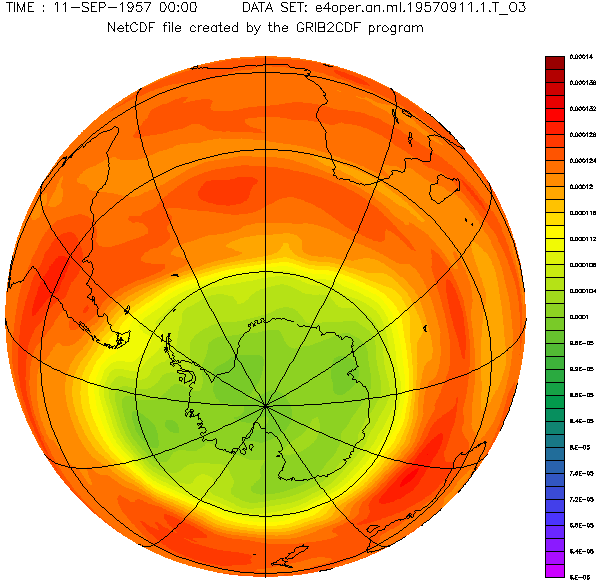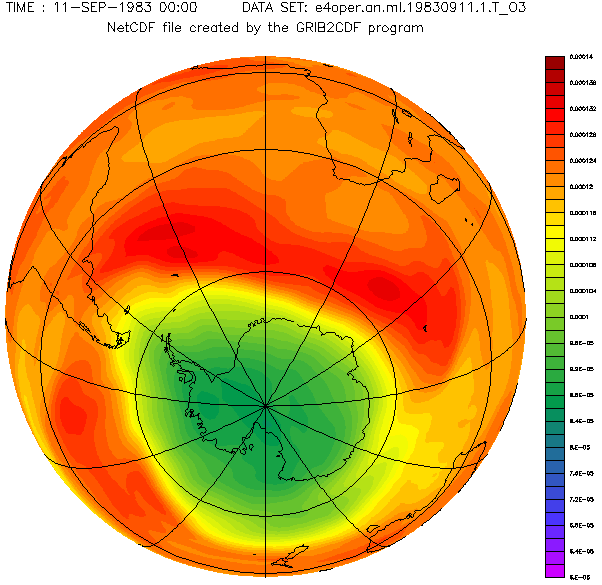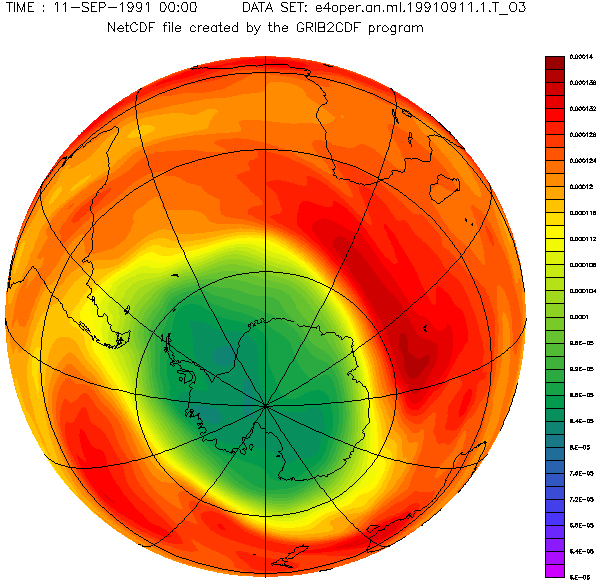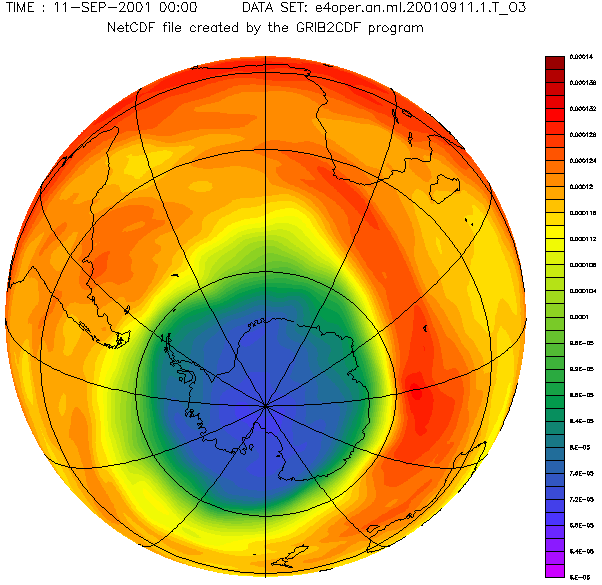 Concentration d'ozone au-dessus de l'hémisphère sud.
Concentration d'ozone au-dessus de l'hémisphère sud.
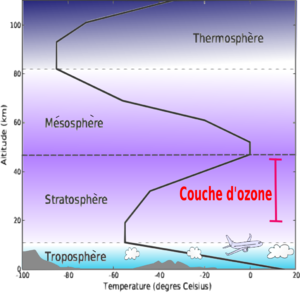
La couche d'ozone ou ozonosphère désigne la partie de la stratosphère contenant une quantité relativement importante d'ozone (concentration de l'ordre d'un pour cent mille). Son existence est démontrée en 1913 par Henri Buisson et Charles Fabry grâce à son interféromètre optique. Cet ozone est produit par l'action du rayonnement solaire sur les molécules de dioxygène à haute altitude (entre 20 et 50 km d'altitude).
À cette haute altitude, la couche d'ozone a pour effet d'absorber la plus grande partie du rayonnement solaire ultraviolet, qui se trouve être dangereux pour les organismes vivants.
On distingue :
- le « bon ozone » présent dans la couche stratosphérique (objet de cet article), bon car il nous protège des rayons UV-C (ultraviolet) ;
- le « mauvais ozone » présent dès la couche basse de l'atmosphère (troposphère : du sol jusqu'à environ 20 km d'altitude), « mauvais » car c'est celui que nous respirons et qui présente selon sa concentration une certaine toxicité (voir Normes de qualité de l'air).
En l'absence de cette couche d'ozone, la vie n'aurait été possible que dans les océans[réf. nécessaire], à une profondeur suffisante de la surface des eaux (les UV ne pénétrant qu'en surface). Ce fut le cas au cours de l'éon Archéen, lorsque l'atmosphère de la Terre était dépourvue de dioxygène (et donc d'ozone).
À la fin des années 1970, des recherches scientifiques en Antarctique ont mis en évidence une diminution périodique de l'ozone dans cette région polaire. Ce que l'on a appelé le « trou de la couche d'ozone ». Il se forme au printemps dans l'Antarctique (à la fin de la nuit polaire) et s'agrandit pendant plusieurs mois avant de se réduire.
Sommaire
L'ozone stratosphérique
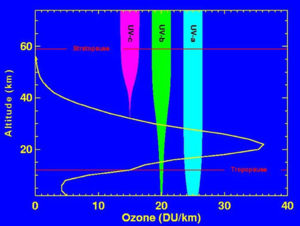
Cet ozone stratosphérique qui s'étend entre 20 et 50 km d'altitude, est en réalité très dilué dans l'atmosphère locale.
En fait, si cet ozone était regroupé, concentré à l'état pur, il aurait dans les conditions normales de température et de pression (c'est-à-dire les conditions moyennes à la surface de la Terre) une épaisseur de seulement 3 mm, soit 300 unités Dobson (DU)[1]. On remarquera que c'est cette couche d'ozone si ténue qui protège la vie des rayons ultraviolets.
Processus de formation
L'ozone est produit à partir du dioxygène, composé de deux atomes d'oxygène.
Aux altitudes supérieures à 30 km, le rayonnement solaire possède encore une énergie suffisante pour casser une partie des molécules de dioxygène et libérer les atomes. Un atome d'oxygène tendant à ne pas rester seul pour des raisons de stabilité, doit se recombiner à un autre élément ; il interagit donc avec une autre molécule de dioxygène (O2) présente pour former une nouvelle molécule, composée de trois atomes d'oxygène : l'ozone (O3).
-
- O2 + rayonnement solaire → O + O et O + O2 → O3
Cette réaction chimique est la seule qui, dans la stratosphère, produise de l'ozone.
Mais puisqu'il y demeure encore de l'oxygène, il existe donc un facteur limitant sa concentration. Primitivement, une certaine quantité d'ozone s'est formée il y a environ deux milliards d'années et elle constitue le réservoir d'ozone de l'atmosphère. La concentration observée aujourd'hui résulte d'un équilibre entre la production d'ozone par le rayonnement solaire, et certains processus de destruction : tout l'ozone produit en « trop plein du réservoir » est détruit. C'est ce que l'on appelle un équilibre dynamique.
D'autres études, menées à l'aide de ballons évoluant à haute altitude et de satellites météorologiques, ont révélé que la proportion d'ozone au-dessus de l'Antarctique est en baisse. Des vols au-dessus de l'Arctique ont mis en évidence des problèmes similaires dans cette région.
Un équilibre dynamique
Le jour, à haute altitude, le rayonnement solaire peut dissocier la molécule d'ozone en une molécule de dioxygène et un atome d'oxygène :
-
- O3 + rayonnement → O2 + O
Durant la nuit et en particulier la nuit polaire, cette réaction n'existe pas puisqu'il n'y a plus de rayonnement solaire. Une autre réaction devient alors prépondérante : la recombinaison d'un atome d'oxygène et d'une molécule d'ozone pour donner deux molécules de dioxygène :
-
- O3 + O → 2 O2
Mais l'ensemble de ces deux réactions ne peut rendre compte que de 20 % de la destruction naturelle de l'ozone, alors que pour parvenir à un équilibre il faut que la perte soit égale à la production. Ce problème met en évidence la fragilité de l'équilibre de l'ozone. En effet, si les deux réactions ci-dessus avaient pu suffire à compenser la surproduction d'ozone, l'équilibre de ce dernier ne dépendrait que de la quantité de dioxygène présent dans la haute atmosphère, et cet équilibre aurait été difficilement perturbable, mais les composés chlorés perturbent cet équilibre. Les composés bromés, et les oxydes d'azotes (NOx) contribuent également à cette destruction.
L'action des composés chlorés
Parvenues dans la stratosphère, les molécules de composés chlorés sont décomposées par le rayonnement solaire, les produits de cette décomposition détruisant les molécules d'ozone par le jeu de réactions catalytiques[2].
Les sources naturelles de chlore
La seule source naturelle de chlore est le chlorure de méthyle, principalement produit dans les océans par les micro-organismes, les algues[réf. nécessaire]. La concentration ne dépasse pas 0,6 milliardième : c'est à cela que se limite le fond naturel de chlore dans l'atmosphère.
Les chlorofluorocarbures
Inventés dans les années 1930, les chlorofluorocarbures ont connu un développement important à partir des années 1950 à cause de leurs propriétés remarquables (ininflammables, facilement compressibles, non solubles) et, comme ils n'ont qu'une faible réactivité chimique, on les croyait peu toxiques pour l'environnement. Utilisés principalement dans l'industrie du froid, dans les bombes aérosols comme propulseur, en solvants pour l'industrie électronique, dans les mousses synthétiques et les agents extincteurs ; ils sont essentiellement dus à l'activité humaine.
La production des CFC est très importante. Pour les deux principaux, le trichlorofluorométhane (CFC 11) et le dichlorofluorométhane (R 21), la production est passée de 50 000 à 100 000 t au début des années 1960 jusqu'à 500 000 t en 1999. Cela représente une croissance de 5 à 6 % par an, soit pratiquement un doublement de la quantité tous les dix ans.
Diffusion dans la basse atmosphère
Les vents brassent l'atmosphère en permanence :
- Horizontalement, avec un temps moyen de transport d'un pôle à l'autre de l'ordre de deux ou trois ans.
- Verticalement, avec une homogénéisation de l'atmosphère jusqu'à 80 km d'altitude.
En deux à trois ans, les CFC se retrouvent donc dans l'atmosphère sous toutes les latitudes, aussi bien à l'équateur qu'aux pôles. Puis, en quinze ans, ils montent dans la haute atmosphère.
Accumulation dans la stratosphère
À cela s'ajoute un autre effet, les CFC présents dans la stratosphère en 1997 sont ceux qui ont été produits entre 1977 et 1982, ce qui ne représente que 40 % de ce qui a été produit jusqu'à ce jour.
Les 60 % restants sont encore en train de se mélanger et de monter. Du fait de ce retard, les effets des CFC produits ces dernières années se feront encore sentir dans 60 ans.
Bilan
Ainsi, la quantité de chlore naturellement présente dans la stratosphère est d'environ 0,6 milliardième, alors qu'aujourd'hui la proportion totale de chlore atteint 3,5 milliardièmes. Elle a été multipliée par 5 en 20 ans, ce qui a entraîné une rupture de l'équilibre dynamique.
En hiver, la destruction d'ozone est nulle. Au printemps, elle est très importante car il y a déjà des UV, beaucoup de cristaux de glace dans la stratosphère et parce que la circulation atmosphérique, le vortex polaire autour de l'Antarctique, empêche le remplacement de l'ozone détruit.
Dès la fin du printemps, l'amincissement est moins important parce que la quantité de cristaux de glace diminue, et aussi parce que la circulation atmosphérique change : il y a alors un mélange entre l'air antarctique et l'air venu du nord qui apporte de l'ozone.
Données sur la couche d'ozone
Perte continue d'ozone en Antarctique
La couche d'ozone est aujourd'hui observée par un réseau de stations au sol et au moyen de satellites artificiels construits, entre autres, par la NASA.
C'est en 1985 que l'alerte a été donnée avec la découverte d'une diminution importante de la concentration d'ozone au cours des mois de septembre et d'octobre au-dessus du continent Antarctique. Une réduction de près de 50 % du contenu total d'ozone était observée, se produisant au cours du printemps austral et couvrant toute la surface de l'Antarctique.
Depuis la fin des années 1970, l'épaisseur de l'ozone est passée, en certains endroits, de l'équivalent de 3 mm à 2 et même 1,5 mm aujourd'hui, en moyenne pour le mois d'octobre.
C'est cette diminution relative de l'épaisseur de la couche d'ozone stratosphérique (par rapport à son épaisseur standard ou initiale de 300 DU), que l'on nomme « trou d'ozone » ou « trou dans la couche d'ozone ».
En 2000, 2001 et 2003, le trou dans la couche d'ozone a atteint une superficie jamais observée avant 2000, alors que celui de 2002 était le plus petit qui ait été observé depuis 1998. En effet, à la fin de l'été 2003, le trou a de nouveau atteint un record de superficie… pour diminuer rapidement durant le mois d'octobre. En 2006, un nouveau record a été enregistré au-dessus de l'Antarctique.
En 2006, l'ONU et les experts alertent sur le fait que la couche d'ozone se reconstitue moins vite que prévu, en raison probablement de l'utilisation persistante de gaz interdits, de type CFC, mais peut-être aussi à cause de l'effet de serre et des traînées de condensation laissées par les avions[réf. nécessaire]. Ces dernières, avec d'autres émetteurs de gaz à effet de serre, contribuent en réchauffant les basses couches de l'atmosphère à priver les hautes couches d'une partie des calories provenant du rayonnement du sol. Ces hautes couches se refroidissent, or le froid intensifie les réactions chimiques de destruction de l'ozone[réf. nécessaire].
Le trou dans la couche d'ozone a atteint une superficie record fin septembre 2006 et une épaisseur minimale record début octobre, aux alentours de 0,8 DU.[réf. nécessaire] À cette époque, à Ushuaia, petite ville du sud de l'Argentine (non loin de l'Antarctique), les habitants ont été contraints de ne pas sortir découverts, car ils risquaient des irradiations.[réf. nécessaire]
Perte d'ozone en Arctique
Dans l'océan Arctique, l'ampleur du phénomène n'atteint pas encore celle qui est observée dans l'hémisphère Sud.
Le fait que la perte d'ozone, si importante en Antarctique, soit moindre au-dessus de l'Arctique découle des différences climatiques entre ces deux régions. Le refroidissement de la stratosphère polaire est en effet moins intense au nord où, en moyenne, les températures sont de 15 à 20 °C supérieures à celles observées au pôle Sud.
Cette différence de comportement entre les deux pôles est directement liée à la géographie : le continent antarctique est isolé au milieu des océans dans l'hémisphère Sud. Dans l'hémisphère Nord, au contraire, une alternance de continents et d'océans, de zones de hautes et de basses pressions atmosphériques contribue à créer un mouvement continu des masses d'air tel que le pôle Nord ne reste jamais totalement isolé. L'air des latitudes moyennes, plus chaud, arrive donc toujours au pôle, y augmentant ainsi les températures moyennes.
En exploitant des données fournies par un satellite de la NASA chargé de la recherche de la haute atmosphère, les chercheurs ont remarqué que les nuages stratosphériques de l'Antarctique ont une durée de vie deux fois plus longue que ceux situés au-dessus de l'Arctique.
Le satellite MetOp-A a observé le trou d'ozone en 2007
L'action des ultraviolets sur les organismes vivants
Les ultraviolets sont des agents mutagènes : ils détériorent l'ADN des cellules, ce qui dérègle leurs activités biologiques (ex: cancer) ou les détruit (coup de soleil). Le 9 octobre 2003, au sud du Chili, la couche d'ozone qui avait perdu 50 % de son épaisseur habituelle, offrait si peu de protection contre les ultraviolets que ce jour-là, il suffisait de passer cinq minutes dehors sans protection pour attraper un coup de soleil[réf. nécessaire]. Le sud du Chili n'est pas la seule zone atteinte, d'autres régions de l'Australie et de la Nouvelle-Zélande ont également connu des épisodes semblables. De plus, les rayons ultraviolets perturbent les divisions cellulaires des micro-organismes aquatiques, ce qui a de graves conséquences sur la vie aux pôles[3]. En plus des cancers de la peau, on observe aussi un affaiblissement général du système immunitaire.
L'action planétaire pour la préservation de la couche d'ozone
Mesures prises
- Le protocole de Montréal, signé en septembre 1987 puis révisé à Londres, Copenhague, Montréal et Pékin jusqu'en 1999, a préconisé une diminution des émissions de 50 % en dix ans.
- L'Union européenne a proposé en 1989 une interdiction totale de l'utilisation des CFC durant les années 1990, qui fut approuvée par les États-Unis. L'Union Européenne s'est ensuite dotée en 2000 d'un règlement européen (2037/2000) visant à transposer le Protocole de Montréal en droit européen, tout en fixant des objectifs plus ambitieux de réduction ou d'interdiction de certains gaz détruisant la couche d'ozone.
L'avenir
Les délégués de 190 pays réunis à Montréal le 12 septembre 2007 ont pu saluer, 20 ans après la signature du protocole, la réussite du projet qui se concrétise par un arrêt total de la production des chlorofluorocarbures prévu en 2010 et une estimation optimiste de la communauté scientifique : la couche d'ozone retrouvera normalement son état de 1980 entre 2055 et 2065. Il était prévu d'éliminer les hydrochlorofluorocarbures, les principaux substituts des chlorofluorocarbures, d'ici à 2020 pour les pays industrialisés et 2040 pour les pays en voie de développement. Des chercheurs ont établi récemment que l'élimination précoce (10 ans plus tôt, soit en 2030) des hydrochlorofluorocarbures réduirait l'effet de serre dans une proportion supérieure à ce que doit permettre le Protocole de Kyoto sur le changement climatique. Un accord a été conclu, lors de cette 19e réunion des parties qui permet une accélération de la sortie de l'utilisation des hydrochlorofluorocarbures. En vertu de cette entente, la production de ces substances sera gelée en 2013 à son niveau moyen de 2009-2010. Les pays industrialisés arrêteront la production et la consommation en 2020, réduisant celles-ci à 75 % en 2010 et 90 % en 2015 (0,5 % sont autorisés pour la maintenance). Les pays en développement réduiront de 10 % en 2015, 35 % en 2020, 67,5 % en 2025, gardant 2,5 % en moyenne sur les cinq dernières années pour la maintenance. Le succès du Protocole de Montréal montre que la communauté internationale est capable de résoudre les problèmes environnementaux.
Notes et références
- ↑ « DU » en anglais, Dobson Unit en hommage au spécialiste anglais G.M.B Dobson, un des premiers scientifiques à étudier la couche d'ozone et inventeur du spectromètre Dobson. Une unité DU correspond à 0,01 mm d'épaisseur à température et pression atmosphérique standard.
- ↑ Catalytique signifie que le constituant qui attaque l'ozone est régénéré à la fin de la réaction. À travers une succession de ces réactions en chaîne, un unique atome d'un constituant peut donc permettre la destruction d'un très grand nombre de molécules d'ozone (de l'ordre de 10 000 à 100 000). Dès lors, des constituants dont l'abondance relative ne se chiffre pourtant qu'en milliardièmes peuvent suffire à contrôler chimiquement l'équilibre de l'ozone, dont l'abondance relative est pourtant mille fois supérieure.
- ↑ L'arrivée des ultraviolets provoque non seulement des cancers de la peau, mais aussi des mutations de l'ADN des organismes vivants. Ces modifications consistent en la réalisation d'une nouvelle liaison, notamment entre deux thymines situées sur le même brin d'ADN. Ces deux thymines forment alors un dimère de thymine qui perturbe le fonctionnement des cellules de peau et qui peut provoquer leur mort. Toutefois, ces cellules possèdent un mécanisme de réparation (NER) capable de dissocier les dimères de thymines éventuellement formés après une exposition aux UV.
Bibliographie
- Gérard Mégie, L'ozone stratosphérique, Tec & Doc Lavoisier, coll. « Rapport de l'Académie des sciences », 1998, 271 p. (ISBN 2743002565) [présentation en ligne].
- Patrick Aimedieu, L'ozone stratosphérique, Presses universitaires de France, coll. « Que sais-je? », 1996, 127 p. (ISBN 2130474438).
Voir aussi
Liens externes
- L'ozone stratosphérique sur Environnement Canada
- Programme des Nations Unies pour l’Environnement - Secrétariat de l’Ozone sur UNEP
- La production de gaz qui appauvrissent la couche d'ozone en France sur IFEN
- Voir le trou dans la couche d'ozone en temps réel d'après des données de satellites de la NASA sur NASA
- Portail de l’environnement et du développement durable
- Portail de l’écologie
Catégories : Climatologie | Atmosphère terrestre
Wikimedia Foundation. 2010.