- Lumière oxhydrique
-
Une lumière oxhydrique faite maison, réalisés par chauffage d'hydroxyde de calcium, dans un rond de cuisinière.

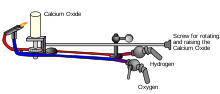
La lumière oxhydrique dite également lumière Drummond est émise par un bloc de matière réfractaire porté à l'incandescence par la flamme d'un chalumeau oxhydrique (combinaison de l'oxygène et de l'hydrogène). Ce procédé, permettant d'obtenir une lumière très vive a été développé par Goldsworthy Gurney, en 1823[1],[2]. Cette source lumineuse fut ensuite utilisée par un officier de la marine britannique Thomas Drummond, lors d'une mission topographique. Drummond remplaça l'argile utilisée par Gurney par de la chaux afin d'obtenir une lumière encore plus vive[2]. Comme « chaux », se dit « lime » en anglais et « lumière », « light », les anglophones nomment cette lumière « limelight ».
Sommaire
Histoire
« Oui, mes amis, je crois que l’eau sera un jour employée comme combustible, que l’hydrogène et l’oxygène, qui la constituent, utilisés isolément ou simultanément, fourniront une source de chaleur et de lumière inépuisables et d’une intensité que la houille ne saurait avoir. Un jour, les soutes des steamers et les tenders des locomotives, au lieu de charbon, seront chargés de ces deux gaz comprimés, qui brûleront dans les foyers avec une énorme puissance calorifique. Ainsi donc, rien à craindre. Tant que cette terre sera habitée, elle fournira aux besoins de ses habitants, et ils ne manqueront jamais ni de lumière ni de chaleur, pas plus qu’ils ne manqueront des productions des règnes végétal, minéral ou animal. Je crois donc que lorsque les gisements de houille seront épuisés, on chauffera et on se chauffera avec de l’eau. L’eau est le charbon de l’avenir[3]. » (Jules Verne L'Île mystérieuse 1874)
En 1766, Henry Cavendish, le premier, détermina la nature du gaz hydrogène qu'il désigna sous le nom de gaz inflammable et qu'il produisit avec du zinc, de l'acide et de l'eau. Priestley continua les études de Cavendish et ce fut Antoine Lavoisieren 1783 qui donna enfin au nouveau corps le nom d'hydrogène[4].
En 1823: Goldsworthy Gurney démontre la possibilité de produire de la lumière (light en anglais) avec un cylindre de chaux (lime en anglais) soumis à l'action de la flamme d'un mélange oxygène-hydrogène, nommée lumière oxhydrique. Cette source lumineuse fut ensuite utilisée par un officier de la marine britannique Thomas Drummond, lors d'une mission topographique. Drummond remplaça l'argile utilisée par Gurney par de la chaux afin d'obtenir une lumière encore plus vive. Comme « chaux », se dit « lime » en anglais et « lumière », « light », les anglophones nomment cette lumière « limelight ».
La lumière oxhydrique dite également lumière Drummond est émise par un bloc de matière réfractaire porté à l'incandescence par la flamme d'un chalumeau oxhydrique (combinaison de l'oxygène et de l'hydrogène). Ce procédé, permettant d'obtenir une lumière très vive a été développé par Goldsworthy Gurney, en 1823.
Utilisation dans les théâtres
La douceur de la lumière oxhydrique et son bon Indice de rendu de couleur en fait un moyen d'éclairage de choix dans les théâtres et autres lieux de spectacle à partir des années 1830:
« La douceur de la lumière oxhydrique, sa régularité parfaite, sa teinte légèrement jaunâtre, l'ont fait admettre dans plusieurs théâtres de Paris, et qu'elle fait merveille, notamment dans la Riche au bois, Peau d'âne, Cendrillon, etc. Pour sa production dans ces établissements publics, on a recours le plus ordinairement, comme cela a lieu au Théâtre de la Renaissance, à des sacs en caoutchouc. Deux poches disposées entre des châssis pressés convenablement et chargés de poids en fonte pour faire ainsi office de soufflet, et contenant l'une de l'hydrogène, l'autre de l'oxygène, fabriqués au théâtre même, sont mis en rapport par des tuyaux de conduite, avec un appareil spécial nommé chalumeau, par où ils viennent se mélanger convenablement et se rendre dans une petite chambre ou barillet. Ce mélange se forme d'une partie d'oxygène pour deux parties d'hydrogène; c'est la même proportion qui produit l'eau, lorsque ces deux gaz se combinent au lieu de se mélanger. Le mélange effectué prend le nom de gaz oxhydrogène; il s'échappe par un bec disposé de manière à lancer son jet enflammé sur un petit cylindre de chaux ou de magnésie calcinée; il acquiert alors tout son rayonnement, tout son éclat. La chaleur engendrée par ce jet de gaz enflammé atteint 2000 degrés centigrades ; il fond le platine, volatilise les métaux les plus réfractaires; et la lumière produite jouit de cette propriété remarquable que toutes les nuances du vert et du bleu s'y distinguent parfaitement, même dans leurs tons les plus rapprochés. Très riche en rayons chimiques, cette lumière permet d'obtenir des épreuves photographiques parfaitement réussies[5]. »
La lumière oxhydrique comme moyen d'éclairage dans les théâtres sera progressivement remplacée à partir de 1880 par la lampe à incandescence développée par Thomas Edison[6].
Il nous en est resté l'expression « feux de la rampe ».
Utilisation pour l'éclairage public
Un mémoire du Société des ingénieurs civils de France en 1868 encourage l'utilisation de l'oxygène à la place du gaz de houille. Des expériences sont tentées pour abaisser le coût de production de l'oxygène et une première réalisation concrète est réalisée sur la place de l'hôtel de ville à l'instigation du barron Haussmann:
« La plus importante peut-être est sa parfaite innocuité; et, sous ce rapport, on peut dire que sa supériorité sur tous les autres modes d'éclairage en usage est absolue. En effet, cet éclairage, apportant avec lui le gaz combustible et le gaz comburant, n'a pas besoin d'emprunter à l'air ambiant l'oxygène qui est nécessaire à la combustion des autres gaz i il ne vicie donc pas l'air, et dispenserait, pour tous les éclairages intérieurs, de l'emploi des ventilateurs, ventouses, etc., indispensables aujourd'hui.
Quelques mots sont nécessaires pour faire apprécier cet avantage capital de la lumière oxhydrique: Le gaz d'éclairage ordinaire absorbe moins d'oxygène, pour produire une égale lumière, que la chandelle, la bougie ou la lampe; pourtant,on trouve chez les divers auteurs, et notamment dans l'ouvrage de Clegg (dont nous devons à notre collègue, M. Servier, une excellente traduction française), qu'un mètre cube de gaz ordinaire exige, pour sa complète combustion, 2 mètres cubes d'oxygène pur pour se transformer en eau et en acide carbonique.
Or, l'air renfermant environ 20 pour 100 d'oxygène, un mètre cube de gaz exige donc 10 mètres cubes d'air pour sa combustion. Ce seul chiffre suffira pour faire apprécier immédiatement l'avantage considérable de l'éclairage oxhydrique, sous ce rapport, et on peut en dire, dès à présent, que c'est un éclairage éminemment hygiénique. Ceci indiqué, on apercevra de suite beaucoup d'applications (toutes particulières â l'éclairage oxhydrique), qui peuvent résulter de cette précieuse faculté de brûler sans le concours de l'air. C'est ainsi qu'on a déjà songé à produire la lumière oxhydrique dans des ballons en verre absolument clos et sans communication directe avec l'air extérieur. — Cette application exige, naturellement, des dispositions spéciales pour le dégagement régulier de la vapeur d'eau ou des gaz résultant de la combustion; mais on conçoit aisément que si cet éclairage réussissait bien, il pourrait rendre d'immenses services pour les travaux des mines, en les préservant des accidents du feu grisou; il pourrait s'appliquer également à l'éclairage sous-marin et augmenter considérablement les services qu'on peut attendre des scaphandres; enfin il s'appliquerait aussi avec de notables avantages dans les fabriques de poudre, de produits chimiques, les filatures, etc.[7]. »L'usage du dioxygène et de l'hydrogène comme gaz d'éclairage implique de dédoubler les canalisations, et l'emploi de régulateurs, pour maintenir exacte, la proportion des deux gaz à la sortie des brûleurs.
« On a dit et écrit que le nouvel éclairage oxhydrique doublerait les frais d'établissement des usines et de la canalisation : c'est là de l'exagération. — Pour qu'il en fût ainsi, il faudrait que la quantité d'oxygène à produire ne diminuât pas celle de l'hydrogène : or, nous savons déjà que pour une égale puissance lumineuse, la quantité de gaz ordinaire, ou d'hydrogène pur, nécessaire à la lumière oxhydrique, est considérablement moindre que pour l'éclairage ordinaire. Si l'éclairage oxhydrique devait un jour se généraliser, il faut bien se rappeler que la même quantité, des deux gaz réunis, donnant au moins 5 fois plus de lumière que le gaz actuel seul, les usines nouvelles auraient à produire 5 fois moins de gaz que les anciennes, pour le même éclairage[8]). »
Cependant le risque d'explosion est bien plus important que pour le gaz de houille:
« Il y a encore à craindre de laisser côte à côte des canalisations susceptibles de fuites, et contenant des gaz dont la réunion peut former un mélange éminemment détonant. Cette considération serait relativement plus grave, contre la lumière oxhydrique, si le gaz ordinaire, mêlé à l'air, n'était pas lui-même détonant. Mais là, non plus, il ne faut rien exagérer : la densité spécifique des deux gaz est tellement différente, qu'à moins qu'ils ne soient contenus en vase clos, le mélange ne se formera pas aisément. Si le mélange oxhydrique détonant rencontrait les conditions nécessaires à sa formation, il lui faudrait encore, comme au mélange d'air et de gaz ordinaire, la chaleur ou l'électricité pour produire sa détonation : il n'y aurait de différence, avec le gaz ordinaire, que dans le plus ou moins de violence de l'explosion. Dans un cas comme dans l'autre, il y a des précautions à prendre ; comme il y en a avec la vapeur, avec l'électricité, avec tous les éléments que l'homme a soumis à sa loi[8]. »
Utilisation
L'innocuité de la lumière oxhydrique ( l'oxygène nécessaire à la combustion n'étant pas pris dans l'air ambiant comme c'est le cas pour les éclairages au gaz de ville dont la combustion vicie l'air) et son bon Indice de rendu de couleur en firent une source lumineuse de choix pour les théâtres et autres lieux de spectacle à partir des années 1830.
La lumière oxhydrique fût remplacée à partir de 1880 par la lampe à incandescence développée par Thomas Edison[6].
Notes et références
- Porter, p. 137
- Lami, p. 525
- Jules Verne L’Île mystérieuse - Partie 2, Chapitre 11 1874
- Désiré Magnier Nouveau manuel complet de l'éclairage au gaz, ou Traité élémentaire et pratique à l'usage des ingénieurs, directeurs, etc. LIBRAIRIE ENCYCLOPÉDIQUE DE FORET 1849 (Livre numérique Google)
- Musée des familles: Lectures du soir, Volume 36. 1869 (Livre numérique Google)
- Louise Poissant, Esthétique des arts médiatiques: interfaces et sensorialité, PUQ, 2003, p. 252
- Mémoires et compte-rendu des travaux. Société des ingénieurs civils de France.1868. Livre numérique Google
- Moigno (François Napoléon Marie, abbé). Les Mondes: revue hebdomadaire des sciences et leurs applications aux arts et à l'industrie, Volume 18. 1868 (Livre numérique Google
Annexes
Bibliographie
- Eugène-Oscar Lami, Dictionnaire encyclopédique et biographique de l'industrie et des arts industriels, Librairie des dictionnaires, 1882. vol. 2 (OCLC 42673892)
- Dale H. Porter, The life and times of Sir Goldsworthy Gurney gentleman scientist and inventor, 1793-1875, Bethlehem, Pa. : Lehigh University Press, 1998. (ISBN 9780585188973)
Articles connexes
Wikimedia Foundation. 2010.