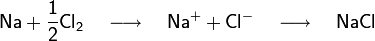- Liaisons ioniques
-
Liaison ionique
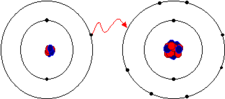 Configuration électroniques du lithium et du fluor. Le lithium a un électron dans sa couche de valence alors que le fluor en a sept. Si un électron est transféré du lithium au fluor, les deux atomes deviennent des ions qui possèdent la configuration électronique d'un gaz rare. Ces deux ions de charge opposée s'attirent d'où le concept de liaison ionique
Configuration électroniques du lithium et du fluor. Le lithium a un électron dans sa couche de valence alors que le fluor en a sept. Si un électron est transféré du lithium au fluor, les deux atomes deviennent des ions qui possèdent la configuration électronique d'un gaz rare. Ces deux ions de charge opposée s'attirent d'où le concept de liaison ionique
Une liaison ionique (ou liaison électrovalente) est un type de liaison chimique qui peut être formé par une paire d'atomes possédant une grande différence d'électronégativité, typiquement entre un non-métal et un métal. Le métal donne un ou plusieurs électrons pour former un ion chargé positivement (cation). Le non-métal capte ces électrons pour former un ion chargé négativement (anion). Les deux ions formés possèdent fréquemment une configuration électronique de gaz rare (ils respectent la règle de l'octet). La liaison résulte de l'attraction entre le cation dérivant du métal et l'anion dérivant du non-métal.
Par exemple, le sel de cuisine est du chlorure de sodium (NaCl). Quand le sodium (Na) réagit avec le chlore (gaz de dichlore, Cl2), les atomes de sodium perdent un électron et les atomes de chlore gagnent un électron (la molécule de dichlore est d'abord dissociée). Les ions se combinent dans un rapport 1 : 1 pour former le sel de cuisine.
Le fait d'enlever des électrons à des atomes est endothermique (les potentiels d'ionisation sont supérieurs à 0) : Les cations produits sont toujours de plus haute énergie que l'atome de départ. L'addition d'électrons aux atomes pour former des anions est au contraire un processus exothermique mais la stabilisation peut être nulle, faible ou très importante (voir l'article affinité électronique). L'attraction électrostatique entre des ions de charge opposée, est, elle, toujours favorable. Le bilan de la la formation d'une liaison ionique est donc favorable pour la combinaison d'un atome perdant facilement un ou des électron(s) (potentiel d'ionisation faible) avec un autres atome possédant une affinité électronique élevée. Autrement dit la combinaison la plus favorable est celle d'un non-métal d'électronégativité élevée avec un métal d'électronégativité faible. Par extension, des ions polyatomiques (comme l'ammonium NH4+ ou le carbonate CO32- peuvent entrer se combiner avec des ions de charge opposée pour former des solides stables.
Contrairement à la liaison covalente, la liaison ionique n'est pas dirigée ni localisée. Dans un cristal ionique les anions et les cations s'attirent mutuellement dans toutes les directions de l'espace. Il n'y a pas de paires d'atomes liés. Même si le chlorure de sodium s'écrit NaCl, cela ne signifie pas que des molécules de NaCl séparées les unes des autres existent
La liaison ionique pure n'existe pas. Tous les composés présentent un degré de liaison covalente. Plus la différence d'électronégativité entre deux atomes est importante, plus la liaison est ionique. les composés ioniques conduisent l'électricité à l'état fondu ou en solution. Ils possèdent généralement un point de fusion élevé et sont souvent solubles dans l'eau.
Liste d'ions courants
Cations Nom UICPA Formule Nom historique Cations simples Aluminium Al3+ Baryum Ba2+ Béryllium Be2+ Césium Cs+ Calcium Ca2+ Titane(III) Ti3+ Titane(IV) Ti4+ Chrome(II) Cr2+ Chromeux Chrome(III) Cr3+ Chromique Cobalt(II) Co2+ Cobalteux Cobalt(III) Co3+ Cobaltique Cuivre(I) Cu+ Cuivreux Cuivre(II) Cu2+ Cuivrique Gallium Ga3+ Or(I) Au+ Or(III) Au3+ Hydrogène H+ (Proton) Fer(II) Fe2+ Ferreux Fer(III) Fe3+ Ferrique Plomb(II) Pb2+ Plombeux Plomb(IV) Pb4+ Plombique Lithium Li+ Magnésium Mg2+ Manganèse(II) Mn2+ Manganeux Manganèse(III) Mn3+ Manganique Mercure(II) Hg2+ Mercurique Nickel(II) Ni2+ Nickeleux Nickel(III) Ni3+ Nickelique Potassium K+ Argent Ag+ Sodium Na+ Strontium Sr2+ Étain(II) Sn2+ Stanneux Étain(IV) Sn4+ Stannique Zinc Zn2+ Cations polyatomiques Ammonium NH4+ Hydronium H3O+ Nitronium NO2+ Mercure(I) Hg22+ Mercureux Anions Nom UICPA Formule Nom historique Anions simples Arséniure As3− Azoture N3− Bromure Br− Chlorure Cl− Fluorure F− Hydrure H− Iodure I− Nitrure N3− Oxyde O2− Phosphure P3− Sulfure S2− Peroxyde O22− Oxoanions Arsenate AsO43− Arsenite AsO33− Borate BO33− Bromate BrO3− Hypobromite BrO− Carbonate CO32− Hydrogénocarbonate HCO3− Bicarbonate Chlorate ClO3− Perchlorate ClO4− Chlorite ClO2− Hypochlorite ClO− Chromate CrO42− Dichromate Cr2O72− Iodate IO3− Nitrate NO3− Nitrite NO2− Phosphate PO43− Hydrogénophosphate HPO42− Dihydrogénophosphate H2PO4− Permanganate MnO4− Phosphite PO33− Sulfate SO42− Thiosulfate S2O32− Hydrogénosulfate HSO4− Bisulfate Sulfite SO32− Hydrogénosulfite HSO3− Bisulfite Anions dérivant d'acides organiques Éthanoate C2H3O2− Acétate Méthanoate HCO2− Formiate Oxalate C2O42− Hydrogénooxalate HC2O4− Bioxalate Autres anions Hydrogénosulfure HS− Bisulfure Tellurure Te2− Amidure NH2− Cyanure OCN− Thiocyanate SCN− Cyanure CN− Articles connexes
Liens externes
- Portail de la chimie
Catégories : Liaison chimique | Ion
Wikimedia Foundation. 2010.