- 15356-60-2
-
Menthol
Menthol 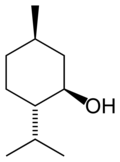
Structure du menthol Général Nom IUPAC 5-Méthyl-2-(1-méthyléthyl)-cyclohexan-1-ol Synonymes - 2-Isopropyl-5-méthylcyclohexanol
No CAS , racémique
, (−)-isomère
(+)-isomèreNo EINECS , racémique
LPubChem FEMA SMILES InChI Apparence Solide cristallin blanc ou incolore Propriétés chimiques Formule brute C10H20O [Isomères] Masse molaire 156,2652 g∙mol-1
C 76,86 %, H 12,9 %, O 10,24 %,Propriétés physiques T° fusion 36 à 38 °C, racémique
42 à 45 °C, (−)-forme (α)
35-33-31 °C, (−)-isomèreT° ébullition 212 °C (485 K) Solubilité légerement soluble dans l'eau Masse volumique 0,890 g/cm³, solide Point d’éclair 93 °C Précautions Directive 67/548/EEC 
XiPhrases R : 41, Phrases S : 2, 26, 37/39, SIMDUT[1] 
Composés apparentés Isomère(s) Citronellol, Dihydrolinalol Unités du SI & CNTP, sauf indication contraire. Le menthol est un composé organique covalent obtenu soit par la synthèse, soit depuis l'extraction à partir de l'huile essentielle de menthe poivrée ou d'autres huiles essentielles de menthe. Le stéréo-isomère le plus courant du menthol est le (-)-menthol, de configuration ( 1R,2S,5R ). Il appartient à la famille des monoterpènes. A température ambiante (20 à 25 °C), il se trouve sous forme solide, d'une couleur d'un blanc cireux. Il fond si l'on augmente légèrement la température. Le menthol a des propriétés anti-inflammatoires et antivirales. Il est d'ailleurs utilisé pour soulager les irritations mineures de la gorge. Il est également un anesthésique local.
Sommaire
Histoire
Le menthol a été découvert au Japon, il y a plus de 2000 ans, mais il n'a été isolé pour la première fois qu'en 1771 par Gambius. Le (-)-Menthol (aussi appelé l-menthol ou (1R,2S,5R)-menthol) se trouve naturellement dans l'huile essentielle de menthe poivrée (Mentha ×piperita). Le menthol japonais contient également un léger pourcentage de (+)-néomenthol.
Structure
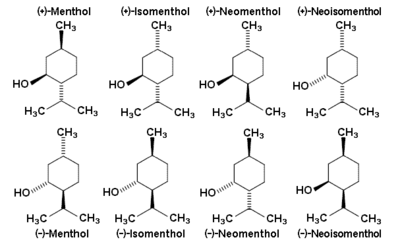
Le menthol existe à l'état natif sous la forme d'un seul énantiomère : (1R,2S,5R), en bas à gauche du schéma.
Dans les composés naturels, le groupement isopropyle est orienté trans. par rapport au deux groupes méthyle et alcool en position cis. Ainsi il peut être dessiné de l'une ou l'autre des façons ci-dessous :
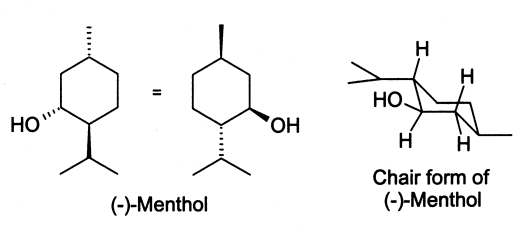
Dans l'état fondamental, chacun des trois substituants sont en position équatoriale, faisant du (-)-menthol et de son énantiomère (1S,2R,5S) les isomères les plus stables. Il existe deux formes cristalline pour le menthol racémique. L'une à des points de fusion de 28 °C et l'autre de 28 °C. Pur, le menthol a quatre formes solides, dont la plus stable est la forme α.
Applications
 Animation d'une représentation en trois dimensions de la molécule de menthol.
Animation d'une représentation en trois dimensions de la molécule de menthol.
Le menthol est inclus dans nombre de produits différents pour plusieurs raisons comme :
- Soulagement à court terme de la gorge endolorie et de l'irritation mineure de la bouche ou de la gorge. (bains de bouche par exemple)
- Antipruritique pour réduire les démangeaisons
- Anesthésique local pour soulager des maux et douleurs mineures telles que des crampes musculaires, entorses, migraines,… Il peut être utilisé seul ou combiné avec du piment ou du camphre. En Europe, il est plutôt utilisé en gel ou en crème
- Décongestionnant pour les voies respiratoires et les sinus (notamment utilisé dans le produit Vicks Vaporub)
- Pesticides contre les acariens
- Dans certains médicaments traitant les brûlures mineures, il produit une sensation de froid (souvent utilisés en application locale, en association avec l'Aloès)
- Additif dans certaines cigarettes, comme saveur ou pour réduire les irritations de la gorge ou des sinus provoqués par le tabagisme
- Il peut également être utilisé comme désinfectant pour l'hygiène orale, ou remède contre la mauvaise haleine, comme collutoires, pâtes dentifrices, et plus généralement comme agent de saveur pour les chewing-gums et les sucreries
- Dans les sodas aussi bien mélangés avec de l'eau pour obtenir une boisson à très faible teneur en alcool, comme dans le Ricqlès par exemple (on fait ici référence à la boisson, et non à l'alcool de menthe de la même marque).
- En versant quelques gouttes d'alcool de menthe sur un morceau de sucre pour soulager la nausée
- En parfumerie, pour préparer des esters menthylés pour agrémenter des notes florales
- En patches pour faire tomber la fièvre ou obtenir une sensation de froid (très développé au Japon)
- Dans certains produits de beautés (produit coiffant par exemple)
Les défenseurs de la pharmacie homéopathique pensent que le menthol interfère avec les médicament homéopathique. Son utilisation est fortement déconseillée en association avec des médicament homéopathique, à tel point de proscrire les dentifrices à base de menthol.
Le menthol peut être utilisé en aromathérapie sous forme d'huile essentielle de menthe poivrée (médicine naturelle) , l'indigestion, la nausée, les maux de gorge, la diarrhée, les maux de tête et les refroidissements (médecine orientale)
Le menthol a une toxicité relativement basse : (Rat) DL50 oral : 3300 mg/kg ; Peau (lapin) DL50 : 15800 mg/kg). En chimie organique, le menthol est utilisé comme auxiliaire chiral dans la synthèse de centres asymétriques.
Synthèse
Comme beaucoup de produits naturels employés couramment, la demande de menthol excède considérablement l'approvisionnement des sources naturelles. Le menthol est fabriqué comme énantiomère simple par Takasago International Cie. sur une échelle de 400 tonnes par an. Le processus implique une synthèse asymétrique développée par une équipe menée par Ryoji Noyori :
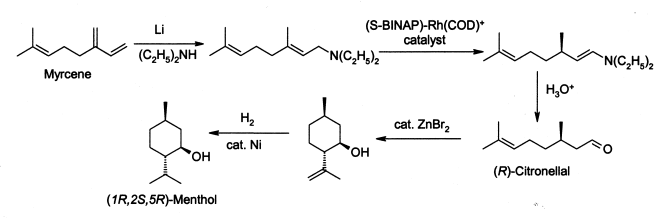
Le processus commence en formant une amine allylique du myrcène, qui subit l'isomérisation asymétrique en présence d'un complexe de rhodium de BINAP pour donner (après hydrolyse) R-citronellal énantiomériquement pur. Le résultat est traité au bromure de zinc pour obtenir l'isopulegol qui est alors hydrogéné pour donner du (1R, 2S, 5R)–menthol pur. Le menthol racémique peut être préparé simplement par l'hydrogénation du thymol, et le menthol est également constitué par l'hydrogénation du pulegone.
Propriétés chimiques
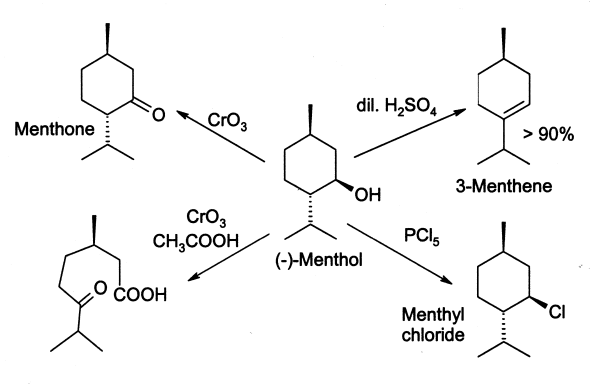
Le menthol réagit souvent de la même façon qu'un alcool secondaire normal. Il est oxydé à la menthone en oxydant des agents tels que l'acide chromique, bien que dans certaines conditions l'oxydation puisse aller plus loin et casser le cycle. Le menthol est facilement déshydraté pour donner principalement le 3-menthene, par l'action de 2% d'acide sulfurique. Le traitement au PCl5 donne du chlorure de menthyl.
Propriétés biologiques
La capacité du menthol de déclencher chimiquement les récepteurs sensibles au froid dans la peau est responsable de la sensation de refroidissement bien connue qu'elle provoque une fois absorbée. Dans ce sens elle est semblable à la capsaïcine, l'espèce chimique responsable de la sensation épicée des poivres.
Notes et références
Voir aussi
Articles connexes
Liens externes
- (en) Colacot T. J. Platinum Metals Review 2002, 46(2), 82-83.
- (en) Ryoji Noyori Nobel lecture (2001)
- (en) Menthol Information
- (en) Cooler than Menthol
Bibliographie
- E. E. Turner, M. M. Harris, Organic Chemistry, Longmans, Green & Co., London, 1952.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- Portail de la chimie
Catégories : Produit chimique irritant | Arôme | Alcool (chimie) | Goût frais | Terpènes et terpénoïdes | Menthe
Wikimedia Foundation. 2010.