- Hydrure d´ aluminium et de lithium
-
Tétrahydruroaluminate de lithium
Tétrahydruroaluminate de lithium 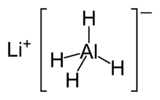
Structure du tétrahydroroaluminate de lithium Général Synonymes hydrure d'aluminium et de lithium No CAS No EINECS PubChem SMILES InChI Apparence poudre blanche inodore Propriétés chimiques Formule brute H4AlLi [Isomères] Masse molaire 37,954 g∙mol-1
H 10,62 %, Al 71,09 %, Li 18,29 %,Propriétés physiques T° fusion 159 °C( se décompose)
déc. >125 °CT° ébullition 184 °C Solubilité Voir tableau Masse volumique 0,917 g/cm³ (solide) à 20 °C Précautions Directive 67/548/EEC 
FPhrases R : 15, Phrases S : 2, 7/8, 24/25, 43, [1] NFPA 704 SIMDUT[2] 

SGH[3] 
DangerÉcotoxicologie DL50 85 mg/kg souris oral
7mg/kg souris i.p.Autre risque d’explosion en contact avec l’air (humidité). Unités du SI & CNTP, sauf indication contraire. Le tétrahydruroaluminate de lithium, aussi appelé hydrure d’aluminium et de lithium (LiAlH4), généralement noté LAH, est un puissant générateur d'hydrures donc un fort réducteur utilisé en chimie organique. Il est plus puissant que le borohydrure de sodium, autre réactif de réduction, car la liaison Al-H est plus faible que la liaison B-H. Il transforme les esters, les acides carboxyliques et les cétones en alcools et les composés nitrés en amines. LAH réagit violemment avec l’eau et le produit pur est pyrophorique. Le produit commercial est conservé dans l’huile minérale pour le protéger de l’air. Pur et cristallisé dans l’éther diéthylique, c’est un solide blanc. Les échantillons commerciaux sont toujours gris à cause de contaminations avec des traces d’aluminium métallique. Des échantillons commerciaux qui ont absorbé suffisamment d’humidité forment un mélange d’hydroxyde de lithium et d’hydroxyde d'aluminium.
De nombreuses recherches sont aussi menées depuis quelques années pour l'utiliser pour le stockage d'hydrogène pour les piles à combustible.
Sommaire
Préparation
Le LAH est normalement synthétisé par réaction entre l’hydrure de lithium (LiH) et le chlorure d'aluminium (AlCl3) :
-
- 4LiH + AlCl3 → LiAlH4 + 3LiCl,
qui présente un taux élevé de conversion (97 %). Le LiH en excès est éliminé par une filtration de la solution de LAH dans l’éther suivie d’une précipitation pour obtenir un produit contenant environ 1 % de LiCl.
Réactions inorganiques
Le LAH et le NaH peuvent être utilisés pour produire le tétrahydruroaluminate de sodium dans le THF avec un rendement de 90,7 % :
-
- LiAlH4 + NaH → NaAlH4 + LiH.
Le tétrahydruroaluminate de potassium peut être préparé de la même manière par réaction dans le diglyme avec un rendement de 90 % :
-
- LiAlH4 + KH → KAlH4 + LiH.
L’inverse, c’est-à-dire la production de LAH à partir de tétrahydruroaluminate de sodium ou d’hydrure de potassium et d’aluminium, peut être obtenu par réaction avec LiCl dans l’éther diéthylique et le THF avec un rendement de 93,5 et 91 % :
-
- NaAlH4 + LiCl → LiAlH4 + NaCl,
- KAlH4 + LiCl → LiAlH4 + KCl.
L’alanate de magnésium peut être synthétisé à partir de LAH et de bromure de magnésium (MgBr2) :
-
- 2LiAlH4 + MgBr2 → Mg(AlH4)2 + 2LiBr.
Utilisations en chimie organique
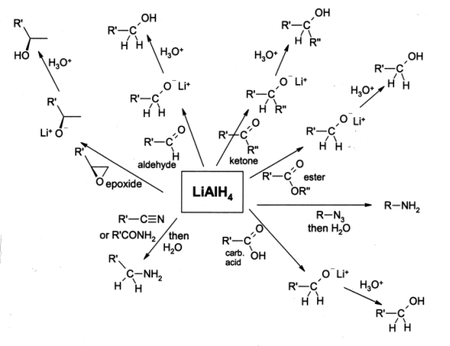
L’hydrure d’aluminium et de lithium est largement utilisé en chimie organique comme agent réducteur puissant. Vu les difficultés de manipulation à cause de sa réactivité, il est surtout utilisé à petite échelle ; pour des quantités plus grandes, on utilise plutôt l’hydrure de sodium bis(2-méthoxyéthoxy)aluminium. Comme réducteur, le LAH est normalement utilisé dans l’éther diéthylique et un lavage à l’eau est effectué après la réduction pour retirer les sous-produits inorganiques (ions lithium, sel d'aluminiumm). Il est surtout utilisé pour la réduction d'éther-oxydes, d'esters et des acides carboxyliques donnant un alcool primaire ; avant l’apparition du LAH , on utilisait le sodium métallique dans l’éthanol bouillant (la réduction de Bouveault-Blanc). Des aldéhydes et des cétones peuvent aussi être réduites en alcool par le LAH mais, en général, on utilise un réactif plus doux comme le borohydrure de sodium (NaBH4). Lorsque les époxydes sont réduits avec le LAH, le réactif attaque la partie la moins encombrée de l’époxyde et en général le produit est un alcool secondaire ou tertiaire. Les amines peuvent être préparées par la réduction au LAH d’amides, de nitriles, de composés nitrés ou d’alkylazides. Le LAH est aussi capable de réduire les halogénures d’alkyle en alcanes. L’hydrure d’aluminium et de lithium n’est pas capable de réduire de simples alcènes ou des noyaux benzéniques et les alcynes ne sont réduites qu’en présence d’un groupement alcool.
Décomposition thermique
À la température ambiante, LAH est normalement stable, quoique, durant un stockage prolongé, il peut se décomposer lentement en Li3AlH6. Cette dégradation peut être accélérée par la présence d’un catalyseur comme un des métaux : Ti, Fe,V. Quand il est chauffé, le LAH se décompose par la réaction en trois étapes :
-
- LiAlH4 → 1/3 Li3AlH6 + 2/3 Al + H2 (R1) ;
- 1/3 Li3AlH6 → LiH + 1/3 Al + ½ H2 (R2) ;
- LiH → Li + 1/2H2 (R3).
La réaction R1 est en général initiée par la fusion du LAH de 150 à 170 °C et immédiatement suivie par sa décomposition en Li3AlH6. À partir de 200 à 250 °C, Li3AlH6 se décompose en LiH (réaction R2) et au-dessus de 400 °C, il se décompose aussi en Li (réaction R3). Vu la présence d’aluminium métallique, la réaction solide peut produire des alliages Li-Al. A moins d’être catalysées, les réactions R1 et R2 sont réellement irréversibles. Au vu des réactions R1 à R3, le LiAlH4 contient 10,6 % d’hydrogène en masse et, pour cela, pourrait être un bon réservoir d’hydrogène pour les futures cellules de piles à combustible destinées à équiper des véhicules.
Solubilité
Le LAH est soluble dans beaucoup d’éthers. Cependant, il peut se décomposer spontanément en présence d’impuretés. Pour cela, il semble être plus stable dans le THF. Ainsi, ce dernier est préféré, par exemple, au diéthyl éther malgré sa moindre solubilité.
Solubilité du LiAlH4 (mol/l) Température (oC) Solvant 0 25 50 75 100 Diéthyl éther -- 5,92 -- -- -- THF -- 2,96 -- -- -- Monoglyme 1,29 1,80 2,57 3,09 3,34 Diglyme 0,26 1,29 1,54 2,06 2,06 Triglyme 0,56 0,77 1,29 1,80 2,06 Tétraglyme 0,77 1,54 2,06 2,06 1,54 Dioxane -- 0,03 -- -- -- Dibutyl ether -- 0,56 -- -- -- Structure cristalline
La structure cristalline de LAH est monoclinique. Cette structure est consistuée d’atomes de Li entourés par cinq tétraèdres AlH4. Les atomes de lithium sont entourés d’un atome d’hydrogène pour chaque tétraèdre voisin créant une pyramide. À haute pression, (> 2,2 GPa), il y a transition de phase vers la phase βLAH.
Données thermodynamiques
Le tableau résume les données thermodynamiques pour LAH et pour les réactions où LAH intervient.
Données thermodynamiques pour les réactions concernant LiAlH4 Reaction ΔHo (kJ/mol) ΔSo (J/(mol K)) ΔGo (kJ/mol) Commentaire Li(s) + Al(s) + 2H2(g) 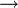 LiAlH4(s)
LiAlH4(s)-116,3 -240,1 -44,7 Standard de formation à partir des éléments. LiH(s) + Al(s) + 3/2H2(g) 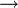 LiAlH4(s)
LiAlH4(s)-25,6 -170,2 23,6 Utilisant ΔHof(LiH) = -90,5 ; ΔSof(LiH) = -69,9 et ΔGof(LiH) = -68,3. LiAlH4(s)  LiAlH4(l)
LiAlH4(l)22 -- -- Chaleur de fusion. Valeur incertaine. LiAlH4(l)  1/3Li3AlH6(s) + 2/3Al(s) + 1/2H2(g)
1/3Li3AlH6(s) + 2/3Al(s) + 1/2H2(g)3,46 104,5 -27,68 ΔSo calculée à partir des valeurs publiées de ΔHo et ΔGo. Notes et références
- ↑ « tétrahydruroaluminate de lithium » sur ESIS, consulté le 18 février 2009
- ↑ « Tétrahydroaluminate de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé de l'aluminium | Composé du lithium | Produit chimique facilement inflammable | Produit chimique qui réagit avec l'eau | Produit chimique corrosif | Hydrure | Réactif pour la chimie organique -
Wikimedia Foundation. 2010.