- Dystrophie myotonique de Steinert
-
Dystrophie myotonique de Steinert Référence MIM 160900 Transmission Dominante Chromosome 19 q13.2-q13.3 Gène DMPK Empreinte parentale Non Mutation Expansion de triplet Mutation de novo Rare Nombre d'allèles pathologiques Sans objet Anticipation Oui maternelle Porteur sain Sans objet Prévalence 1/20 000 Maladie génétiquement liée Aucune Diagnostic prénatal Possibe Liste des maladies génétiques à gène identifié modifier 
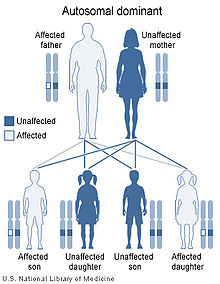
La dystrophie myotonique de Steinert ou maladie de Steinert est une maladie génétique autosomique dominante, à pénétrance incomplète et marquée par l'anticipation, qui affecte plusieurs organes : le squelette, les muscles lisses, l'œil, le cœur, le système endocrinien et le système nerveux central.
Les signes de cette maladie sont variés allant d'une forme légère à grave. Trois formes sont habituellement décrites selon l'âge d'apparition des premiers symptômes mais dont les limites ne sont pas toujours nettes : légère, classique et congénitale.
- La forme légère est caractérisée par une cataracte et une myotonie modérée. L'espérance de vie est normale.
- La forme classique est caractérisée par une faiblesse musculaire généralisée et une myotonie généralisée, une cataracte et des troubles de la conduction cardiaque. L'adulte peut perdre son autonomie et l'espérance de vie est réduite si le patient n'est pas suivi pour le coeur.
- La forme congénitale avec une hypotonie musculaire, souvent associée à une insuffisance respiratoire avec décès précoce. Le retard mental est fréquent dans cette forme.
La mutation est une expansion instable d'un triplet CTG du gène DMPK. Ce triplet est répété plus de 37 fois chez les personnes atteintes. Le nombre de répétitions du triplet CTG est généralement associé à la sévérité de la maladie ainsi qu'à l'âge d'apparition des symptômes.
Sommaire
Autres noms
- Myotonie dystrophique de type 1
- Dystrophie myotonique de type 1
Étiologie
Mutation du gène DMPK (pour Dystrophy Myotonic Protein Kinase) situé sur le locus q13-2 chromosome 19 codant la myotonine, une Protéine Kinase AMPc dépendante, dont le rôle précis est inconnu[1]. La mutation en cause est une expansion du triplet CTG dont le nombre dépasse 37 chez les personnes atteintes. Lorsque le nombre de répétition est supérieur à 50, la maladie se manifeste toujours. Dans la forme congénitale, l'expansion du triplet atteint plusieurs milliers.
Prévalence et incidence
La prévalence de cette maladie est de 1 sur 100 000 au Japon et 1 sur 10 000 en Islande. La prévalence mondiale de cette maladie est de 1 sur 20 000. La prévalence mondiale la plus élevée atteint 189 sur 100 000 de population dans la région du Saguenay-Lac-Saint-Jean au Québec (Canada).
Description de la maladie
Patient de 40 ans
Phénotype Signes cliniques Longueur du triplet Âge du début des signes Espérance de vie Prémutation Aucun 35-50 Sans objet Sans objet Moyenne Cataracte
Myotonie50-150 20 à 70 ans 60 ans à normale si suivi cardiaque Classique Faiblesse musculaire
Myotonie
Cataracte
Trouble de la conduction cardiaque
Calvitie100-1000 10 à 30 ans 48 ans à normale si suivi cardiaque Congénitale Myotonie
Détresse respiratoire
Retard mentalSupérieur à 2000 0 à 10 ans 45 ans à normale si suivi cardiaque et pulmonaire Diagnostic
- La présomption du diagnostic repose sur l'association de signes cliniques variés (p. ex., cataracte, calvitie, troubles musculaires et cardiaques). La myotonie est le relachement lent de la contraction musculaire volontaire (main qui reste serrée après une poignée de main, par exemple).
- La certitude du diagnostic est obtenue par une technique de biologie moléculaire, avec un prélèvement sanguin. Le consentement de la personne prélevée est indispensable. La technique de TP-PCR est utilisée et suffit à éliminer les sujets sains (nombre de CTG inférieur à 37), hétérozygotes pour le nombre de répétitions du triplet CTG sur le gène DMPK (les deux allèles comportent moins de 37 répétitions). Chez les homozygotes sains et les hétérozygotes avec expansion (ils ont un allèle à moins de 37 répétitions, et un allèle à plus de 37, et généralement plus de 50 CTG), on réalise une vérification par Southern blot. Les hétérozygotes avec expansion sont atteints de la Dystrophie myotonique de Steinert.
- La présence d'un cas de Dystrophie de Steinert au sein d'une famille doit déclencher une enquête familiale. Là encore, l'enquête génétique n'est possible qu'avec l'accord explicite des personnes prélevées.
Différentiel
- Myotonie dystrophique type 2 secondaire à une expansion de CCTG du gène ZNF9
- Myopathie à corps d'inclusion
- Myopathie avec surcharge en desmine
Complications
Une mort subite est possible, soit par troubles du rythme ventriculaire soit par trouble de la conduction cardiaque, et ce, d'autant qu'il existe des anomalies sur l'électrocardiogramme[2].
Références
- Brook JD, McCurrach ME, Harley HG, et als. Molecular basis of myotonic dystrophy: expansion of a trinucleotide (CTG) repeat at the 3' end of a transcript encoding a protein kinase family member, Cell, 1992;68:799-808
- Groh WJ, Groh MR, , Saha C et Als. Electrocardiographic abnormalities and sudden death in myotonic dystrophy Type 1, N Eng J Med, 2008;358:2688-2697
Sources
- (fr) Dystrophie myotonique de Steinert AFM
- (fr) Dystrophie myotonique de Steinert Québec Portail
- (en) Online Mendelian Inheritance in Man, OMIM (TM). Johns Hopkins University, Baltimore, MD. MIM Number: 160 900 [1]
- (en) Thomas D Bird, Myotonic Dystrophy Type 1 In : GeneReviews at GeneTests: Medical Genetics Information Resource (database online). Copyright, University of Washington, Seattle. 1997-2005. [2].
- (fr) Article sur Orpha.net du Dr Alexandre Moerman et du Professeur Sylvie Manouvrier [3]
- Portail de la médecine
- Portail de la biologie cellulaire et moléculaire
Wikimedia Foundation. 2010.