- 10049-07-7
-
Trichlorure de rhodium
Trichlorure de rhodium (III) Général Nom IUPAC Trichlorure de rhodium (III) Synonymes Chlorure de rhodium (III) No CAS (anhydre) Numéro RTECS VI9290000 (anhydre) No EINECS Apparence Solide cristallin rouge Propriétés chimiques Formule brute RhCl3 Masse molaire 209,265 g∙mol-1
Cl 50,82 %, Rh 49,17 %,Propriétés physiques T° fusion 449,9 °C (?) Masse volumique 5,38 (20 °C, solide) Thermochimie ΔfH0solide −234 kJ/mol Cristallographie Réseau de Bravais octaèdrique Précautions Directive 67/548/EEC 
XnPhrases R : 22, 36/37/38, Phrases S : 26, 37/39, SIMDUT[1] Produit non classifié Composés apparentés Cations apparentés Chlorure de cobalt (III)
Chlorure d'iridium (III)
Chlorure de ruthénium (III)Anions apparentés Fluorure de rhodium (III)
Bromure de rhodium (III)
Iodure de rhodium (III)Unités du SI & CNTP, sauf indication contraire. Le chlorure de rhodium (III) correspond généralement au trichlorure de rhodium hydraté, un composé de formule chimique RhCl3(H2O)3. Il existe également un autre chlorure de rhodium courant, de formule RhCl3, qui est un polymère inorganique de structure AlCl3. Les deux chlorures de rhodium ont des comportements différents. La plupart des réactions chimiques utilisant du chlorure de rhodium mettent en jeu la forme hydratée. Certains mode opératoires utilisant du chlorure de rhodium nécessite l'utilisation de Na3RhCl6 qui est une forme activée de rhodium (III).
Les chlorures de rhodium (III) sont des produits issus de la séparation du rhodium des autres éléments du groupe du platine.
Sommaire
Propriétés
RhCl3(H2O)x est un solide cristallin rouge sombre, diamagnétique. Il est faiblement hygroscopique. Il est soluble dans l'eau et forme des solutions rouges dont la composition dépend du vieillissement. Ces solutions sont un mélange en proportions variables de RhCl3(H2O)3, [RhCl2(H2O)4]+, et [RhCl(H2O)5]2+.
Préparation
RhCl3(H2O)3 est produit sous l'action de l'acide chlorhydrique sur l'oxyde de rhodium (III) hydraté. RhCl3(H2O)3 peut être recristallisé à partir d'une solution concentrée d'acide chlorhydrique. Cette méthode permet d'éliminer les impuretés contenant de l'azote.
RhCl3 est produit par la réaction du dichlore avec une éponge de rhodium à une température comprise entre 200 °C et 300 °C. La réaction équivalente dans un bain de chlorure de sodium fondu conduit à la formation de Na3RhCl6.
Complexes de coordination
RhCl3(H2O)3 est utilisé pour préparer une grande variété de complexes. Les complexes du rhodium (III) sont généralement inertes du point de vue cinétique et de structure octaèdrique, contrairement aux composés du rhodium (I) qui sont généralement planaires.
Amines
Les solutions de RhCl3(H2O)3 dans l'éthanol réagissent avec l'ammoniaque pour former le chlorure pentaamine [RhCl(NH3)5]2+. Une réduction de ce cation par le zinc suivie d'une addition de sulfate conduit à l'hydrure incolore [RhH(NH3)5]SO4.
Thioéthers
Les solutions de RhCl3(H2O)3 dans l'éthanol réagissent avec les thioéthers.
-
- RhCl3(H2O)3 + 3 SR2 → RhCl3(SR2)3 + 3 H2O
Phosphines ternaires
La réaction de RhCl3(H2O)3 avec des phosphines ternaires dans des conditions douces conduit à des composés d'addition similaires aux thioéthers. Lorsque cette réaction a lieu dans l'éthanol à ébullition, la réaction permet d'obtenir des composés du rhodium I dont le catalyseur de Wilkinson RhCl(PPh3)3. L'éthanol joue alors vraisemblablement le rôle d'agent réducteur.
Pyridine
La réaction de RhCl3(H2O)3 avec un mélange d'éthanol et de pyridine à ébullition conduit au trans-[RhCl2(py)4)]Cl. La même réaction conduite dans l'eau, en absence de l'éthanol qui joue le rôle d'agent réducteur, conduit à RhCl3(pyridine)3, analogue aux dérivés des thioéthers.
L'oxydation à l'air d'une solution aqueuse d'éthanol, de pyridine et de RhCl3(H2O)3 conduit à la formation de [Cl(py)4Rh-O2Rh(py)4Cl]5+, composé bleu paramagnétique.
Alcènes
La réaction de RhCl3(H2O)3 avec des oléfines conduit à la formation de composés de type Rh2Cl2(alcène)4. En rêgle générale, les réactifs utilisés pour cette réaction sont des dialcènes tels que le norbornadiène ou le 1,5-cyclooctadiène.
Le ligand oléfine peut être éliminé par décomplexation en utilisant du cyanure.
Monoxyde de carbone
Si RhCl3(H2O)3 est maintenu sous agitation dans une solution de méthanol sous 1 bar de monoxyde de carbone, l'anion dicarbonyldichlororhodate(I) ([RhCl2(CO)2]−) se forme. Le traitement de RhCl3(H2O)3 solide par un flux de CO conduit à la formation de [RhCl(CO)2]2, un solide rouge qui se dissous dans des alcools en présence de chlorures pour former le dichlorure.
De nombreux composés de type Rh-CO-PR3 (R = groupement organique) ont été préparés au dans le cadre d'étude de catalyseur pour la réaction d'hydroformylation. RhCl(PPh3)3 réagit avec le monoxyde de carbone pour former le trans-RhCl(CO)(PPh3)2, qui est un composé analogue au complexe de Vaska en moins réactif. Le même complexe peut être préparé en utilisant le formaldéhyde en lieu et place du monoxyde de carbone.
Rhodium et catalyse
Au cours des années 1960, il a été montré que RhCl3(H2O)3 peut jouer le rôle de catalyseur pour une grande variété de réactions mettant en jeu CO, H2, et les alcènes. Par exemple, RhCl3(H2O)3 permet la dimérisation de l'éthylène pour former un mélange de cis- et trans- but-2-ène :
-
- 2 C2H4 → CH3-CH=CH-CH3
Cette réaction ne se produit pas avec des alcènes comportant plus de carbone.
Au cours des décénies suivantes, cependant, les catalyseurs à base de rhodium ont permis le développement de réactions dans des solvants organiques en utilisant des ligands organiques en lieu et place de l'eau. Ces découvertes, parmi d'autres, ont permis l'émergence de la catalyse homogène.
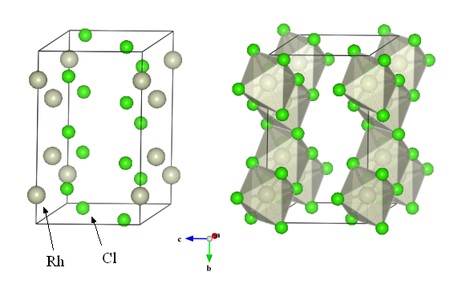
Structure cristalline
Le trichlorure de rhodium cristallise dans une structure monoclinique (structure type AlCl3), avec un groupe d'espace C 2/m. La maille monoclinique possède les caractéristiques suivantes [2] :
a = 5.95 Å
b = 10.3 Å
c = 6.03 Åβ = 109.2 °
Au sein de la maille, les atomes de rhodium occupent les positions 4g (y=0.167), les atomes de chlore occupent quant à eux deux positions, les positions 4i (x=0.226, z=0.219) et 8j (x=0.25, y=0.325, z=0.219). Les atomes de rhodium se situent donc au centre d'octaèdres d'atomes de chlore. Ces octaèdres liés par les arrêtes et les sommets forment une structure en couches.
Bibliographie
- (en) Greenwood, N. N.; & Earnshaw, A., Chemistry of the Elements, Butterworth-Heinemann, Oxford, 1997
- (en) Canterford, J. H.; & Colton, R., Halides of the Second and Third Row Transition Metals, Wiley-Interscience, London, 1968
- (en) Cotton, S. A., Chemistry of the Precious Metals, Chapman&Hall, 1997
Références
- ↑ « Trichlorure de rhodium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ H. Bärnighausen, B.K. Handa, Die Kristallstruktur von rhodium(III)-chlorid, Journal of the less common metals, 6, pp226 (1964).
Liens externes
- Hazard.com (Fiche sécurité)
(en) Cet article est partiellement ou en totalité issu d’une traduction de l’article en anglais intitulé « Rhodium(III) chloride ».
- Portail de la chimie
Catégories : Composé du rhodium | Produit chimique nocif | Chlorure -
Wikimedia Foundation. 2010.