- Acide borique
-
Acide borique 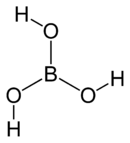
Représentation de la molécule d'acide borique Général Nom IUPAC acide borique
borate d'hydrogèneSynonymes Acide boracique
Acide orthoboriqueNo CAS No EINECS Code ATC AA03 No E E284 SMILES InChI Apparence cristaux incolores ou poudre blanche sans odeur[1]. Propriétés chimiques Formule brute H3BO3 [Isomères] Masse molaire[2] 61,833 ± 0,008 g·mol-1
H 4,89 %, B 17,48 %, O 77,63 %,Propriétés physiques T° fusion 171 °C (décomposition)[1] Solubilité 47,2 g·l-1 (eau, 20 °C)[3] Masse volumique 1,435 g·cm-3 (15 °C)[4] Pression de vapeur saturante 2,7 mbar à 20 °C[3] Thermochimie S0gaz, 1 bar 295,23 J.mol-1•K S0solide 88,7 J.mol-1•K ΔfH0gaz -992,28 kJ.mol-1 ΔfH0solide -1093,99 kJ.mol-1 Précautions Directive 67/548/EEC[3] 
TPhrases R : 60, 61, Phrases S : 45, 53, SIMDUT[5] 
SGH[3] 
DangerPeau irritations possibles Yeux irritations possibles Ingestion Toxique. Vomissements et diarrhée à petites doses, fatal à hautes doses. Unités du SI & CNTP, sauf indication contraire. L'acide borique (acide boracique ou acide orthoborique) est un acide faible souvent employé comme antiseptique, insecticide, absorbeur de neutron, dans les centrales nucléaires pour contrôler le taux de fission de l'uranium, et comme précurseur d'autres composés chimiques.
Il tire son nom de l'un de ses composants, le bore, sa formule brute est la suivante : H3BO3 ou B(OH)3.
Quand il se présente sous forme de minerai, on le désigne sous le nom de sassolite. Il existe sous forme de cristaux incolores ou de poudre blanche se dissolvant dans l'eau.
Sommaire
Fabrication
L'acide borique est produit principalement à partir de minerai de borate par sa réaction avec l’acide sulfurique. La plus grande source de borates dans le monde est une mine à ciel ouvert située à Boron (en), Californie, USA.
L'acide borique a été produit pour la première fois par Wilhelm Homberg (1652-1715) à partir du borax, sous l'action d’acides minéraux, et a reçu le nom de « sal sedativum Hombergi ».
Dans la nature...
L'acide libre est présent sous forme native dans certaines zones volcaniques telles que la Toscane, les îles Lipari et au Nevada, ses effluents sont mélangés à la vapeur issue des fissures de la croûte terrestre. En Toscane, on récupère l'acide borique dans des jets de vapeur d'eau surchauffée (100 à 215 °C) d'origine volcanique, exploités comme source d'énergie ; la vapeur, hydrolysant des borates dans les profondeurs du sol de cette région, contient en effet de l'acide borique et divers sels minéraux. Celle qui s'échappe librement des fissures du sol (soffioni) est simplement condensée dans des bassins (lagoni).
La présence de l'acide borique ou de ses sels a été retrouvée dans l’eau de mer, et on dit qu'il existe également dans les végétaux et plus particulièrement dans presque tous les fruits (A.H. Allen, Analyst, 1904, 301) où il pourrait jouer un certain rôle d'insecticide naturel.L'acide borique est aussi un constituant de nombreux minerais (borax, boracite, boronatrocalcite et colemanite).
Propriétés
L'acide borique est soluble dans l’eau bouillante. Au-dessus de 170 °C il se déshydrate, formant l’acide métaborique HBO2. L'acide métaborique est un cristal cubique, blanc et légèrement soluble dans l'eau. Il fond à environ 236 °C et une fois chauffé au-dessus de 300 °C, il se déshydrate en formant l'acide tétraborique ou l’acide pyroborique, H2B4O7. Le terme d’acide borique peut se rapporter à l’un ou l’autre de ces composés. À une température plus élevée il se forme du trioxyde de bore. L'acide borique ne se dissocie pas en solution aqueuse, mais son activité acide est due à son interaction avec les molécules d’eau :
-
- B(OH)3 + H2O = modifier] Toxicité et écotoxicité
- Il est peu toxique pour l'homme (INRS) par voie digestive ou par inhalation. Certains groupes ethniques l'utilisent cependant comme additif alimentaire pour l'homme ou l'animal domestique. Au Canada, l'ACIA demande aux éleveurs et restaurateurs de ne pas l'utiliser en raison d'un « risque inacceptable pour la santé du consommateur» (suite à des mortalités d'adultes ou bébés)[6].
- À forte concentration il est irritant pour les yeux, la peau et les voies respiratoires - en cas d'exposition courte - , mais peut avoir des effets sur le rein en cas d'exposition prolongée ou d'expositions répétées.
On connaît mal sa toxicité environnementale, sauf pour les insectes contre lesquels il est utilisé comme insecticide autorisé pour certains usages dans certains pays. Les insectes se contaminent en se nettoyant après un contact avec ce produit. Il agit sur leur estomac, conduisant à la mort de l'insecte en une dizaine de jours. Son efficacité persiste plusieurs années dans les endroits secs.
Il est souvent considéré comme guère plus toxique que le sel de table (sur la base de la Dose létale 50 estimée à 2 660 mg·kg-1 de masse corporelle) pour l'homme, mais il a une action fongicide et insecticide qui laisse penser qu'il ne serait pas neutre pour l'environnement en cas de pollution importante.- Il est classé repro-toxique 2 (CMR) par la communauté européenne. Son emploi est désormais règlementé.
Utilisations
Utilisations médicales et biologiques
Il peut être utilisé comme antiseptique pour les brûlures ou les coupures et est parfois employé dans les pommades et les onguents ou est utilisé dans une solution très diluée comme bain oculaire (eau boriquée). Comme composé anti-bactérien, l'acide borique peut également être prescrit comme traitement de l’acné.
L'acide borique peut être utilisé pour traiter les levures et les mycoses comme les candidoses (mycoses vaginales) en remplissant de poudre d'acide borique des ovules qui seront insérés dans la cavité vaginale au coucher pendant trois à quatre nuits consécutives. Il est également employé en prévention du pied d'athlète, en insérant la poudre dans les chaussettes ou les bas, et en solution il peut être prescrit pour traiter certaines formes d’otites externes (infection de l'oreille) chez l’homme ou l’animal. Le conservateur dans les flacons d'urine (bouchon rouge) au Royaume-Uni est de l’acide borique. Le borate de sodium, un antiseptique doux, associé à d’autres composants appropriés peut également être proposé en usage externe pour des maladies des yeux, tel que l’œil sec.
Le borate de lithium est le sel de lithium de l'acide borique employé en laboratoire comme tampon pour le gel couramment employé dans les tampons d'électrophorèse des acides nucléiques (appelés Tampon TAE et Tampon TBE). Il peut être utilisé pour l’électrophorèse de l'ADN et de l'ARN, en gel de polyacrylamide et en gel d'agarose.
Il est également souvent utilisé comme insecticide relativement peu toxique, pour l’extermination des cancrelats, termites, fourmis, puces, et beaucoup d'autres insectes. Il peut être employé directement sous la forme de poudre pour les puces et les cancrelats, ou être mélangé avec du sucre ou de la gelée pour les fourmis. C'est également un composant de beaucoup d’insecticides du commerce. Dans cette utilisation, particulièrement dans le cas des cancrelats, l'acide borique sous forme de poudre est appliqué dans les zones fréquentées par les insectes. Les fines particules s'accrochent aux pattes des insectes et causent par la suite des brûlures chimiques mortelles. L'acide borique pour cet usage dans des quartiers résidentiels est commercialisé dans des zones urbaines infestées par les cancrelats.
Utilisation dans l'industrie nucléaire
L'acide borique est employé dans les centrales nucléaires pour absorber les neutrons superflus. Les réactions de fission en chaîne sont généralement déterminées par la quantité de neutrons en présence (issus des fissions précédentes). Le bore a une capacité élevée d'absorption des neutrons et pour cette raison il est ajouté en solution dans le liquide réfrigérant du circuit primaire qui traverse le réacteur. La modification de la concentration d'acide borique dans l'eau est l'un des moyens qui permettent le contrôle du réacteur. Le bore est également mis en solution dans les piscines contenant les assemblages de combustible usagé, avec une concentration suffisamment élevée pour maintenir la piscine en sous-criticité.
Autres emplois
Les borates et l'acide borique ont été employés depuis la période de la Grèce antique pour le nettoyage, la conservation des aliments et d'autres activités.
Dans l'industrie du bijou et de la soudure traditionnelle (plomberie), l'acide borique a été ou est encore employé en combinaison avec l'alcool dénaturé pour réduire l’oxydation de surface et l’importance de l’oxydation sur les métaux pendant les opérations de métallurgie et de soudure.
Le mastic au silicone a été fabriqué à l'origine en ajoutant de l'acide borique à de l’huile de silicone. Maintenant le mastic commercialisé sous différents noms de marque contient également des quantités significatives de l’élément silicium (le silicium lié au silicone permet d’augmenter de 20 % l’élasticité du produit).
L'acide borique est couramment utilisé par les pyrotechniciens amateurs - en solution dans l’alcool - pour donner à la flamme une couleur vert clair, et pour empêcher la formation d’amide pendant la réaction entre l'aluminium et les nitrates : un peu d'acide borique est ajouté à la composition pour neutraliser les amides alcalines qui peuvent réagir avec l’aluminium. Il est également employé en Inde et à travers le monde pour abattre la poussière sur les terrains de sport, pour diminuer le frottement et pour augmenter la vitesse du jeu.
Il est aussi employé dans le traitement des eaux de piscines où il fait partie de la composition de la grande majorité des galets de chlore. En 2010 son emploi sera réglementé en Europe à cause de sa classification CMR - repro-toxique.
Pour l'éradication d'insectes rampants tels que les cafards, à 20-25% dans des appâts de longue durée.
Liens externes
- (fr)Fiche internationale de sécurité
- (fr)Fiche toxicologique de l'INRS
- (en)ChemSub Online: Acide borique
Notes et références
- ACIDE BORIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Boric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 2 août 2010 (JavaScript nécessaire)
- CAS Registry Number: 10043-35-3 sur ntp.niehs.nih.gov. Consulté le 27 novembre 2009
- « Acide borique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Agence canadienne d’inspection des aliments - Bureau de la salubrité des aliments et de la protection des consommateurs - Lettre à l'industrie - BORAX (ACIDE BORIQUE) VENDU COMME ALIMENT OU PRÉSENTÉ COMME TEL
- B(OH)3 + H2O = modifier] Toxicité et écotoxicité
-
Wikimedia Foundation. 2010.