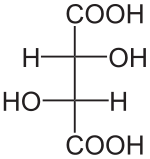
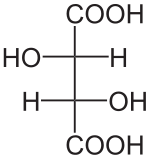
- Acide D-tartrique
-
Acide tartrique
acide tartrique 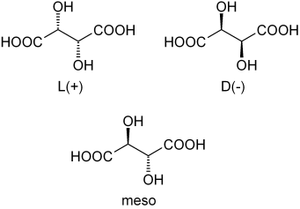
Général Nom IUPAC acide 2,3-dihydroxybutanedioïque Synonymes acide 2,3-dihydroxy succinique No CAS (L(+)-Forme)
(D(−)-Forme)
(meso-Forme)
(DL)No EINECS (L)
(D)
(DL)PubChem No E E334 FEMA SMILES InChI Apparence poudre cristalline blanche.[1] Propriétés chimiques Formule brute C4H6O6 [Isomères] Masse molaire 150,0868 g∙mol-1
C 32,01 %, H 4,03 %, O 63,96 %,pKa 3,04, 4,37 Propriétés physiques T° fusion 206 °C[1] Solubilité dans l'eau : 20.6 g/100 ml à 20 °C[1] Masse volumique (eau = 1) : 1.79[1] T° d’auto-inflammation 425 °C[1] Point d’éclair 210 °C c.o.[1] Précautions NFPA 704 SIMDUT[2],[3],[4],[5] Acide tartrique :

Acide tartarique (d-) :

Acide méso-tartarique :

Acide tartarique (l-) :
Unités du SI & CNTP, sauf indication contraire. L‘acide tartrique est le nom usuel de l'acide 2,3-dihydroxybutanedioïque a pour formule brute C4H6O6.Sa formule semi-développée est HOOC-CHOH-CHOH-COOH. L'acide tartrique est présent dans de nombreuses plantes.Il fut isolé pour la première fois en 1769, par le chimiste suédois Carl Wilhelm Scheele, qui fit bouillir du tartre avec de la craie et décomposa le produit en présence d'acide sulfurique. Il peut être synthétisé. C'est le principal acide du vin (provenant du raisin), sous sa forme L(+).
Les ions tartrates sont utilisés dans la liqueur de Fehling pour tester la présence d'aldéhydes. Le tartrate de potassium évite une cristallisation du vin en bouteille, phénomène exploité dès l'antiquité par les grecs et les romains.
Sommaire
Chimie
Propriétés
L'acide tartrique active la salivation ; il est légèrement laxatif et diurétique. Il se présente sous la forme de cristaux transparents incolores solubles dans l'eau. Les sels de l’acide tartrique sont les tartrates qui sont toujours à craindre et sont évités en traitant le vin par le froid, pour éliminer le maximum de tartre, éventuellement en ajoutant un inhibiteur de cristallisation (acide métatartrique). On détecte l’acide tartrique par le résorcinol.
Isomérie
Louis Pasteur a étudié l'activité optique des isomères optiques des tartrates. La fermentation des jus de raisin produit sur la surface interne du récipient une croûte blanche de tartrate acide de potassium ou tartre brut. Le tartre brut, bouilli en présence d'acide chlorhydrique dilué, précipite sous forme de tartrate de calcium, par addition d'hydroxyde de calcium. Son traitement par de l'acide sulfurique dilué libère la forme dextrogyre (+) de l'acide tartrique, composé qui fait tourner le plan de polarisation de la lumière polarisée vers la droite. L'acide L(+)-tartrique a une température de fusion de 170 °C et est facilement soluble dans l'eau et l'alcool. Il est insoluble dans l'éther. Il existe une autre forme de l'acide tartrique, l'acide D(-)-tartrique (levogyre). Elle a la même structure que la forme L(+), mais fait tourner le plan de polarisation de la lumière vers la gauche. Cet acide fut préparé pour la première fois par Louis Pasteur, à partir du sel d'ammonium et de sodium. L'acide tartrique préparé en laboratoire est un mélange équimolaire des formes dextrogyre (+) et lévogyre (-). Ce mélange, dit racémique, ne modifie pas la direction du plan de polarisation de la lumière. Il existe une autre variété, l'acide mésotartrique, qui ne modifie pas non plus la direction du plan de polarisation de la lumière.
Utilisations
Il est utilisé comme acide solide dans les cachets contre les indigestions et les maux de tête.
Lorsqu’on les met dans l’eau, l’acide se dissout et réagit avec le bicarbonate de sodium pour libérer du dioxyde de carbone gazeux.
Il est utilisé dans l'alimentation comme additif alimentaire (numéro E334[6]), principalement comme antioxydant, régulateur de pH et séquestrant[7]. Il est autorisé dans la plupart des produits alimentaires et dans certains produits spécifiques tels que les produits de cacao et de chocolat, les confitures et gelées, les fruits et légumes en conserve, les pâtes fraîches et les biscuits et biscottes destinés aux nourissons[6].
Il possède aussi une autre utilisation assez courante : dans certains cas précis, il permet, par ses propriétés de recristallisation (acide tartrique L-(+) et D-(-)), de séparer deux énantiomères.
Annexes
Notes et références
- ↑ a , b , c , d , e et f ACIDE TARTARIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide tartrique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ « Acide tartarique (d-) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ « Acide méso-tartarique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ « Acide tartarique (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ a et b Commission européenne, « La directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel, no L 61, 18/03/1995, p. 1-56. [lire en ligne] [pdf]
- ↑ Codex Alimentarius, Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35. [lire en ligne] [pdf]
Articles connexes
Liens et documents externes
- (en) DL-TARTARIC ACID Compendium of Food Additive Specifications (Addendum 7) - Joint FAO/WHO Expert Committee on Food Additives 53rd session - Rome, 1-10 June 1999
- Portail de la chimie
- Portail de la vigne et du vin
Catégories : Produit chimique corrosif | Acide dicarboxylique | Vinification | Saveur acide | Régulateur alimentaire de pH | Séquestrant
Wikimedia Foundation. 2010.