- Cyanure d’hydrogène
-
Cyanure d'hydrogène
Cyanure d'hydrogène 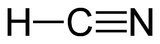
Général Nom IUPAC cyanure d'hydrogène Synonymes Acide cyanhydrique
Acide prussiqueNo CAS No EINECS SMILES InChI Apparence liquide ou gaz incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute HCN Masse molaire 27,0253 g∙mol-1
C 44,44 %, H 3,73 %, N 51,83 %,pKa 9,2 - 9,3 Propriétés physiques T° fusion -13 °C[1] T° ébullition 26 °C[1] Solubilité dans l'eau : miscible[1],
miscible à l'éthanol
soluble dans l'étherMasse volumique (eau = 1) : 0.69 (liquide)[1] T° d’auto-inflammation 538 °C[1] Point d’éclair -18 °C (c.f.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 5.6-40.0[1] Pression de vapeur saturante à 20 °C : 82.6 kPa[1] Viscosité dynamique 0.192 mPa s (20 °C) Thermochimie S0liquide, 1 bar 109 kJ/mol ΔfH0liquide 113,01 J/mol·K Cp 71.09 J mol-1 K-1 (20 °C, liquide)
44.06 J mol-1 K-1 (25 °C, gaz)Précautions Directive 67/548/EEC cyanure d'hydrogène
Phrases R : 12, 26, 50/53,
T+
F+
N
Phrases S : (1/2), 7/9, 16, 36/37, 38, 45, 60, 61,
cyanure d'hydrogène ...%
Phrases R : 26/27/28, 50/53,
T+
N
Phrases S : (1/2), 7/9, 16, 36/37, 38, 45, 60, 61,Transport - 1051 NFPA 704 SIMDUT[2] 


SGH[3],[4] 


Danger


DangerInhalation Très toxique Peau Très toxique Yeux Provoque des conjonctivites Ingestion Très toxique Écotoxicologie LogP -0.25[1] Unités du SI & CNTP, sauf indication contraire. Le cyanure d'hydrogène est un composé chimique de formule chimique H-C≡N. Une solution aqueuse de cyanure d'hydrogène est appelée acide cyanhydrique (ou acide prussique).
Sommaire
Description
Il s'agit d'un produit extrêmement toxique et mortel par anoxie, qui peut exister sous diverses formes. Il a en principe une odeur d’ « amandes amères », mais certaines personnes ne le détectent pas.
Attention à la possibilité d'une erreur fatale : l'acide cyanhydrique ne sent pas lui-même l'amande amère. Lorsqu'il n'est pas chimiquement synthétisé mais qu'il est issu directement de plantes, il se trouve souvent produit en même temps que le benzaldéhyde qui, lui, possède l'odeur caractéristique de l'amande amère ![réf. nécessaire]
Cette odeur, donc, peut être un fort indice de sa présence, bien que ce ne soit pas l'odeur même de l'HCN.Sources naturelles
Extrêmement toxique, l'acide cyanhydrique est produit naturellement par certains végétaux, et peut être trouvé notamment dans les amandes amères, les noyaux de pêche (et plus généralement les noyaux des fruits du genre Prunus), de nèfles, les feuilles de cerisier (Prunus avium) et de laurier-cerise (Prunus laurocerasus), le sorgho (jeune plante et graines non mûres) le sureau hièble. Il intervient aussi dans l’arôme des cerises (comme le benzaldéhyde).
Il est présent dans les cyanohydrines comme les mandelonitriles, et peut en être extrait par voies chimiques. Certains millepattes dégagent du cyanure d'hydrogène comme mécanisme de défense. Il est contenu dans les gaz d'échappement des véhicules à combustion interne, dans la fumée de tabac et dans la fumée de combustion de certaines matières plastiques contenant de l'azote.
Préparation et synthèse
Le cyanure d'hydrogène est produit en grande quantité par deux procédés :
- Dans le procédé Degussa, utilisé pour fabriquer le Zyklon B à destination des camps nazis voués à l'extermination, l'ammoniac et le méthane réagissent à 1 200 °C sur un catalyseur de platine.
CH4 + NH3 → HCN + 3 H2
Cette réaction est semblable à celle du méthane et de l'eau pour former CO et H2 (procédé dit du gaz à l'eau).
- Dans le Procédé Andrussow, on ajoute de l'oxygène :
CH4 + NH3 + 1,5 O2 → HCN + 3 H2O
Cette réaction se produit sur un catalyseur constitué de fils en alliage Platine / Rhodium (généralement 90/10%) à une température d'environ 1100°C
- Le Procédé Shawinigan est assez semblable aux précédents mais utilise des coupes d'hydrocarbures avec comme principal composant le propane:
C3H8 + 3 NH3 → 3 HCN + 7 H2
La réaction a lieu dans un lit fluidisé avec des particules de coke à une température supérieure à 1 300 °C. Aucun catalyseur n'est nécessaire.
- Au laboratoire, de petites quantités d'HCN sont produites par action d'acide sur un cyanure alcalin.
H+ + NaCN → HCN + Na+
Cette réaction est la source d'empoisonnements accidentels.
Propriétés
Propriétés physiques
Le cyanure d'hydrogène se présente, à l'état pur, sous la forme d'un liquide incolore très volatil, ou d'un gaz incolore exhalant une odeur caractéristique d'amandes amères. Il bout à 26 °C.
Il est miscible en toutes proportions avec l'eau et l'éthanol, soluble dans l'oxyde de diéthyle (éther).
Le cyanure d'hydrogène gazeux dans l'air est explosif à partir d'une concentration de 56 000 ppm (5,6 %).
Propriétés chimiques
Le cyanure d'hydrogène pur est stable.
Moins pur, comme il est commercialisé, et s'il n'est pas stabilisé, il polymérise en donnant un dépôt brun. Ce processus, exothermique et autocatalytique, s'accélère en présence d'eau et de produits à réaction alcaline, et peut ainsi conduire à une réaction explosive. Le stabilisant le plus fréquent est l'acide phosphorique, employé dans des proportions de 50 à 100 ppm.
Le cyanure d'hydrogène est faiblement acide et produit des ions cyanure CN- en solution aqueuse. Les sels de l'acide cyanhydrique sont appelés cyanures.
Réactions
HCN + R-CO-R' (cétone ou aldéhyde) → R-C(OH)(CN)-R' (cyanhydrine)
Le cyanure d'hydrogène brûle dans l'air en donnant de l'eau, du dioxyde de carbone et de l'azote.
Chimie prébiotique
L'acide cyanhydrique se serait formé grâce à la dissociation de l'azote moléculaire présent dans l'atmosphère. Les rayons ultraviolets auraient pu réaliser cette réaction, à condition d'être suffisamment énergétiques (longueur d'onde inférieure à 100 nm), ce qui exclut toute réaction dans les couches les plus basses de l'atmosphère où les ultraviolets les plus énergétiques sont absorbés. La voie préférentielle pour synthétiser l'acide cyanhydrique à partir de l'azote semble être les éclairs, qui libèrent une énergie considérable sur leurs parcours, propre à casser de nombreuses molécules. Une fois la molécule d'azote brisée, un atome d'azote peut réagir avec une molécule de méthane (CH4) pour donner de l'acide cyanhydrique et de l'hydrogène.
Utilisations
Le cyanure d'hydrogène est utilisé pour la fabrication :
- de fumigateurs, de pesticides ;
- de nitriles et de résines monomères (l'acrylonitrile, notamment, est utilisé pour la fabrication des fibres acryliques, de matières plastiques : ABS, SAN, d'élastomères) ;
- de chlorure de cyanogène ;
- de percyanooléfines ;
- de cyanures métalliques, ferrocyanures, etc . . .
- en outre, pendant la Seconde Guerre mondiale les nazis ont utilisés l'acide cyanhydrique comme moyen de gazage dans les camps d'extermination, par le biais du Zyklon B.
Sécurité
Voir la section Étiquetage selon les directives CEE, à la fin de cet article.
Risques d'incendie
Le cyanure d'hydrogène, dont le point d'éclair est de -17,8 °C (coupelle fermée) est extrêmement inflammable. Il peut former des mélanges explosifs avec l'air et ses limites d'explosivité sont de 5,6 et 41% en volume.
Etablissements recevant du Public (ERP)
En France, l'arrêté du 4 Novembre 1975 modifié impose que la masse des matériaux inflammables utilisés dans les aménagements intérieurs n'entraîne pas une quantité d'azote pouvant être libérée sous forme d'acide cyanhydrique, supérieure à 5 grammes par m3 du volume du local considéré.
Toxicité pour l'homme
L'intoxication aigüe peut survenir par ingestion, par inhalation, ou par contact avec la peau. Une concentration de 300 ppm dans l'air tue un homme en quelques minutes. Sa toxicité est due à l'ion cyanure. Le cyanure d'hydrogène (sous le nom de Zyklon B) a notamment été employé par le régime Nazi dans les camps d'extermination comme outil d'extermination de masse.
Le seuil de perception olfactive est inférieur à 1 ppm chez les sujets attentifs, sains et non habitués ; cependant, de nombreuses personnes, pour des raisons génétiques, ne perçoivent pas ou peu l'odeur du cyanure d'hydrogène.
Des taux de concentration atmosphériques supérieurs à 50 ppm respirés pendant plus d'½-heure représentent un risque important, alors que des taux de 200 à 400 ppm ou plus sont considérés comme pouvant entrainer la mort après une exposition de quelques minutes. À titre indicatif, la DL50 pour le rat est de 484 ppm pour une exposition de 5 minutes.
Sources
- Institut national de recherche et de sécurité (1997). "Cyanure d'hydrogène et solutions aqueuses". Fiche toxicologique n° 4, Paris:INRS, 5pp. (PDF file, in French).
- ↑ a , b , c , d , e , f , g , h , i et j CYANURE D'HYDROGENE, LIQUEFIE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Cyanure d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Liens externes
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique extrêmement inflammable | Produit chimique dangereux pour l'environnement | Acide | Cyanure
Wikimedia Foundation. 2010.


