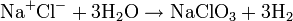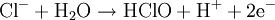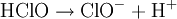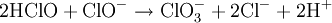- Chlorate de soude
-
Chlorate de sodium
Chlorate de sodium 
Général Nom IUPAC Chlorate de sodium Synonymes chlorate de soude No CAS No EINECS SMILES InChI Apparence cristaux incolores ou granules blancs sans odeur.[1] Propriétés chimiques Formule brute NaClO3 Masse molaire 106,441 g∙mol-1
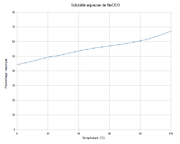
Cl 33,31 %, Na 21,6 %, O 45,09 %,Propriétés physiques T° fusion 248 °C[1] T° ébullition ~300 °C décomposition Solubilité dans l'eau à 20 °C : 100 g/100 ml[1] Masse volumique 2.5 g/cm³[1] Précautions Directive 67/548/EEC 
Xn
O
NPhrases R : 9, 22, 51/53, Phrases S : (2), 13, 17, 46, 61, SIMDUT[2] 
SGH[3] 


DangerUnités du SI & CNTP, sauf indication contraire. Le chlorate de sodium aussi appelé chlorate de soude (NaClO3) est utilisé comme désherbant et il est également utilisé dans le domaine de la pyrotechnie. Les chlorates sont en effet des oxydants plus puissants que les nitrates, quoique plus sensibles également. Ensuite, au niveau puissance oxydante, on arrive aux perchlorates, dont le plus connu: le perchlorate d'ammonium (NH4ClO4) est utilisé comme comburant de certaines fusées (militaires notamment). Le perchlorate de potassium (KClO4) est lui autorisé en pyrotechnie (dans certain pays) car même étant plus puissant que les chlorates, ils sont moins sensibles (à la friction et aux chocs notamment). Le chlorate de sodium et de potassium sont utilisés dans la fabrication de poudres flash, à combustion très rapide. Les chlorates, ont cependant un défaut majeur dans le domaine de la pyrotechnie: si plusieurs coups d'artifices doivent être tirés (pétard, marron d'air,...) le chlorate libérant du di-chlore et du dioxyde de chlore étant irritant pour les voies respiratoires et toxique, même à court terme, ils sont proscrits si de larges nuages de fumées retombaient sur les spectateurs, ou sur des forêts. En Europe, la plupart des pays ont interdit l'utilisation des chlorates en pyrotechnie, du à leur réactivité et leur plus grande puissance. Seuls quelques pays, tels que l'Espagne, autorisent cette utilisation dans certaines pièces d'artifices.
Dans l'industrie des pâtes et papiers, il est utilisé comme produit de base pour substituer le chlore dans les divers stades de blanchiment car il se décompose en dioxyde de chlore (ClO2) et en hydroxyde de sodium (NaOH), aussi appelé soude caustique.
Sommaire
Procédé de fabrication
Le chlorate de sodium est produit par électrolyse à partir d'une solution de saumure. Dans certains procédés, de l'acide chlorhydrique (HCl) est ajouté à la solution de saumure pour réguler le pH ainsi que du dichromate de sodium (Na2Cr2O7) pour réduire la corrosion dans les cuves d'électrolyse. Lors de cette étape, de l'hydrogène et de l'eau de javel (NaOCl) sont produits. Ensuite, la solution d'électrolyte est acheminée vers un cristallisoir afin de former les cristaux qui seront ensuite séchés par un séchoir à lit fluidisé. La partie liquide restante dans le cristallisoir, qui est formé d'ions et de produits n'ayant pas réagi des réactions partielles de l'électrolyse, est réacheminée vers la cuve d'électrolyse pour éviter les pertes de matière.
Équation des réactions
Réaction globale
La réaction globale est en fait une série de petites réactions, soit :
Le chlorate de soude en France
Le chlorate de soude était, il y a de cela quelques années, vendu en grande surface à un taux de >95% de pureté. Toutes personnes pouvaient en acheter, aujourd'hui le chlorate qui se vend au grand public à un taux de 60% car la législation française a été modifiée de par la fréquence des accidents dus au chlorate de soude, et à leur untilisation en tant qu'oxydant dans des réactions explosives. De plus en plus, l'on rencontre le chlorate de soude (désherbant) n'ayant qu'une concentration de 23,7% de NaClO3. Le chlorate à 60% est moins réactif lorsqu'il est mélangé à d'autres substances, ce qui permet d'éviter des accidents mais ce qui diminue fortement l'efficacité du désherbant, alors que le désherbant à 23,7% de NaClO3, n'est pratiquement plus du tout réactif.
Articles connexes
Références
- ↑ a , b , c et d CHLORATE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Chlorate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé du sodium | Produit chimique nocif | Produit chimique comburant | Produit chimique dangereux pour l'environnement | Chlorate | Herbicide
Wikimedia Foundation. 2010.