Chlorate d'hydrogène
- Chlorate d'hydrogène
-
Acide chlorique
| Acide chlorique |
 |
| Général |
| Nom IUPAC |
acide chlorique |
| No CAS |
7790-93-4 |
| Apparence |
solution incolore |
| Propriétés chimiques |
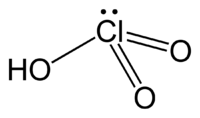
| Formule brute |
HClO3 [Isomères]
|
| Masse molaire |
84,459 g∙mol-1
H 1,19 %, Cl 41,98 %, O 56,83 %,
|
| Propriétés physiques |
| Solubilité |
>40 g/100 ml (eau,20 °C) |
| Précautions |
|
Directive 67/548/EEC
|

C
|

O
|
|
Symboles :
C : Corrosif
O : Comburant
Phrases R :
R8 : Favorise l’inflammation des matières combustibles.
R34 : Provoque des brûlures.
Phrases S :
S17 : Tenir à l’écart des matières combustibles.
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste.
S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette).
S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage.
|
| Phrases R : 8, 34, |
| Phrases S : 17, 26, 36/37/39, 45, |
|
Unités du SI & CNTP, sauf indication contraire.
|
L'acide chlorique est un acide qui a pour formule HClO3 et dont la base conjuguée est l'ion chlorate ClO3−.
Description
L'acide chlorique est l'oxacide à base de chlore V. C'est un acide fort et un oxydant puissant comme ses sels les chlorates. En milieu basique il est thermodynamiquement instable face à sa dismutation en ion chlorure et perchlorate suivant la réaction 4 ClO3- → 3 ClO4- + Cl- mais cette réaction est lente. En présence de réducteurs il peut donner des vapeurs toxiques de ClO2.
Synthèse
On peut préparer des ions chlorates par dismutation d'ions hypochlorite suivant la réaction : 3 ClO- → ClO3- + 2 Cl-.
Utilisations
On utilise surtout des sels d'ions chlorate.
- Le chlorate de potassium est utilisé comme désherbant total en particulier pour obtenir des allées de terre sans aucune herbe. Néanmoins, en raison de son caractère fortement oxydant, il n'est vendu de nos jours qu'en petites quantités et mélangé à d'autres produits. Il sert aussi de transporteur d'oxygène dans les allumettes et les dispositifs pyrotechniques.
- Le « chlorate de soude » ou chlorate de sodium est utilisé principalement pour la génération du dioxyde de chlore (oxydant puissant utilisé pour le blanchiment de la pâte à papier et comme désherbant domestique). Ajoutés au chlorate de sodium, les sels de vanadium renforcent son action herbicide, alors qu'ils sont aussi utilisés en agriculture comme oligo-éléments fertilisants.
 Portail de la chimie
Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique comburant | Oxoacide | Composé du chlore
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Chlorate d'hydrogène de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Chlorate De Sodium — Général Nom IUPAC Chlorate de sodium Synonymes … Wikipédia en Français
Chlorate de soude — Chlorate de sodium Chlorate de sodium Général Nom IUPAC Chlorate de sodium Synonymes … Wikipédia en Français
Chlorate de sodium — Général Nom IUPAC Chlorate de sodium Synonymes chlorate d … Wikipédia en Français
Acide chlorique — Général Nom IUPAC acide chlorique chlorate d hydrogène No CAS … Wikipédia en Français
Nomenclature des acides — En chimie, le terme acide est très général et fait référence à une espèce qui peut, en solution aqueuse, libérer un proton. Avant d entrer dans le détail de la nomenclature, il important de préciser que les acides peuvent être classés en… … Wikipédia en Français
7775-09-9 — Chlorate de sodium Chlorate de sodium Général Nom IUPAC Chlorate de sodium Synonymes … Wikipédia en Français
NaClO3 — Chlorate de sodium Chlorate de sodium Général Nom IUPAC Chlorate de sodium Synonymes … Wikipédia en Français
Liste des numéros ONU — Cette liste répertorie les numéros ONU utilisés dans le transport de matières dangereuses. Sommaire 1 De 0 à 100 2 De 100 à 200 3 De 200 à 300 4 De 300 à 400 … Wikipédia en Français
CHLORE — Le chlore (symbole Cl, numéro atomique 17) est un élément chimique de la famille des halogènes. Sa molécule Cl2 (le dichlore) est un gaz verdâtre plus lourd que l’air. Irritant et suffocant, il fut employé comme gaz de combat pendant la Première… … Encyclopédie Universelle
-ate — Suffixe employé en chimie, pour former des substantifs (ex. sulfate, carbonate). ⇒ ATE, suff. Suff. utilisé en chim. et formateur de subst. masc. I. Sert à désigner les sels ou esters obtenus par l action d un acide en ique (acide plus oxygéné… … Encyclopédie Universelle



