- Perchlorate d'ammonium
-
Perchlorate d'ammonium 
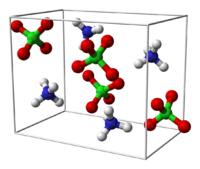
Structure du perchlorate d'ammonium
(en bas : maille cristalline)Général Nom IUPAC Perchlorate d'ammonium No CAS No EINECS SMILES InChI Apparence grains blancs Propriétés chimiques Formule brute NH4ClO4 Masse molaire[1] 117,489 ± 0,004 g·mol-1
H 3,43 %, Cl 30,18 %, N 11,92 %, O 54,47 %,Propriétés physiques T° fusion Se décompose de façon exothermique avant de fondre vers 321,9 à 476,9 °C Solubilité 185 g·l-1 H2O à (15 °C) Masse volumique 1 950 kg·m-3 Précautions Directive 67/548/EEC[2] 
EPhrases R : 3, 9, Phrases S : (2), 14, 16, 36/37, Transport[2] 50 1442
- 0402 NFPA 704 SGH[2],[3] 
DangerUnités du SI & CNTP, sauf indication contraire. Le perchlorate d'ammonium est un composé chimique de formule NH4ClO4. C'est le sel d'ammonium de l'acide perchlorique. Comme les autres perchlorates, c'est un puissant oxydant. On l'obtient par réaction de l'ammoniac NH3 avec l'acide perchlorique HClO4 ou par double décomposition entre un sel d'ammonium et le perchlorate de sodium NaClO4. C'est un solide incolore cristallisé dans le système cristallin trigonal. Lorsqu'on le chauffe, il se décompose avant de fondre, un chauffage doux conduisant à la libération de chlore Cl2, d'azote N2, d'oxygène O2 et d'eau H2O, tandis qu'un chauffage plus fort conduit à l'explosion.
Sommaire
Combustion
La combustion du perchlorate d'ammonium est un sujet complexe abondamment documenté. Les cristaux de NH4ClO4 se décomposent avant de fondre, bien qu'un film liquide ait été observé en surface de cristaux de perchlorate d'ammonium lors de combustions à haute pression[4].
Les produits gazeux de la décomposition des cristaux sont à base de chlore et d'ammoniac dont la combustion ne se maintient pas en dessous d'une pression de 2 MPa, mais le perchlorate d'ammonium est considéré comme dangereux lorsqu'il se présente sous forme pulvérulente à grains de moins de 15 μm.
Lorsqu'il est mélangé à un combustible tel qu'un métal comme l'aluminium ou tel qu'une matrice en polymère organique comme le PBHT, il peut provoquer une combustion auto-entretenue même à des pressions bien inférieures à la pression atmosphérique.
Utilisation
Le perchlorate d'ammonium est un oxydant très utilisé en astronautique dans tout une classe de propergols composites (qu'on appelle pour cette raison propergol composite à perchlorate d'ammonium) propulsant les missiles ballistiques intercontinentaux ou équipant les « boosters » de la navette spatiale et de la plupart des lanceurs commerciaux, jusqu'aux EAP d'Ariane 5.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Ammonium perchlorate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 avril 2011 (JavaScript nécessaire)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- T. L. Boggs, Deflagration Rate, Surface Structure and Subsurface Profile of Self-Deflagrating Single Crystals of Ammonium Perchlorate. AIAA Journal, 8(5), 1970, pp. 867--873
Articles liés
Catégories :- Produit chimique explosif
- Produit chimique comburant
- Composé de l'ammonium
- Perchlorate
- Ergol
Wikimedia Foundation. 2010.


