- CH4S
-
Méthanethiol
Méthanethiol 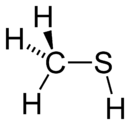
Général Synonymes mercaptan méthylique
mercaptométhane
thiométhane
Sulfhydrate de méthyleNo CAS No EINECS FEMA SMILES InChI Apparence gaz incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute CH4S [Isomères]
CH3-SHMasse molaire 48,107 g∙mol-1
C 24,97 %, H 8,38 %, S 66,66 %,pKa 10,4 Propriétés physiques T° fusion -123 °C[1] T° ébullition 6 °C[1] Solubilité dans l'eau à 20 °C : 2.3 g/100 ml[1] Masse volumique (eau = 1) : 0.9[1] T° d’auto-inflammation 693 K (420 °C) Point d’éclair -18 °C Limites d’explosivité dans l’air en volume % dans l'air : 3.9-21.8[1] Pression de vapeur saturante à 26,1 °C : 202 kPa[1] Précautions Directive 67/548/EEC 
T
F+
NPhrases R : 12, 23, 50/53, Phrases S : 2, 16, 25, 60, 61, [2] Transport - 1064 NFPA 704 SIMDUT[3] 


SGH[4] 



DangerInhalation Vapeurs toxiques à hautes doses Peau Peut provoquer des dermatoses Unités du SI & CNTP, sauf indication contraire. Le méthanethiol (ou méthylmercaptan) est un gaz incolore de la famille des thiols dont l'odeur rappelle celle du chou pourri. C'est une substance naturelle que l'on peut trouver dans le sang, le cerveau et d'autres tissus, animaux ou humains. Elle est également émise par les déjections animales, et on en trouve aussi dans certains aliments comme les noix et le fromage. C'est une des principales substances responsables de la mauvaise haleine. Sa formule chimique est CH3SH et son N°CAS est 00074-93-1.
Sommaire
Produit naturel
Le méthanethiol est un produit de la décomposition de la matière organique des marais et est également présente dans le gaz naturel de certaines régions des États-Unis, dans la houilles et certains pétroles non-raffinés.
À la surface de l'eau de mer, le méthanethiol est le produit principal de la décomposition du métabolite Dimethylsulfoniopropionate (DMSP) des algues. Il semblerait que les bactéries marines récupèrent la plupart de leurs protéines soufrées via la décomposition du DMSP et l'incorporation du méthanethiol et non pas par les sulfates. Pourtant ces dernières sont bien plus concentrés dans l'eau de mer (28 nM contre environ 0,3 nM pour le méthanethiol). Les bactéries d'environnements oxiques et anoxiques peuvent également convertir le méthanethiol en diméthylsulfide (DMS), bien que la plupart du DMS en surface de l'eau de mer soit en réalité produit par d'autres mécanismes. Le DMS et le méthanethiol peuvent tous deux être utilisés par certains microbes comme substrats pour la méthanogenèse de certains sédiments anoxiques.
Le méhanethiol est un acide faible : son pKa est d'environ 10,4. Cette propriété lui permet de réagir avec les métaux dissous dans des solutions aqueuses. Les conséquences environnementales de ces interactions dans l'eau de mer ou douce restent néanmoins à encore étudier.
Consignes de sécurité
Les fiches de sécurité françaises classifient le méthanethiol comme extrêmement inflammable et nocif. Il est toxique à hautes concentrations par inhalation et affecte le système nerveux central en provoquant des maux de tête, des nausées et une irritation du système respiratoire. Son odeur permet néanmoins en principe d'éviter toute intoxication, mais il peut provoquer une dermatose avec la peau. Il est donc recommandé de laver abondamment la peau et les yeux en cas de contact à de fortes concentrations. Le méthanethiol est plus dense que l'air et a tendance à s'accumuler dans les endroits confinés.
Lorsque le méthanethiol brûle, il dégage des gaz toxiques et corrosifs, notamment du dioxyde de carbone, mais aussi du dioxyde de soufre. Il faut également éviter de le laisser en contact avec des oxydants.
En France, ainsi qu'aux États-Unis, en Allemagne et en Grande-Bretagne, la VME (Valeur Moyenne d'Exposition pour 8 heures) est de 0,5 ppm. La CL50 pour 1 heure (Concentration Létale 50%) est de 1350 ppm.
Enfin, le méthanethiol est considéré comme toxique pour les organismes aquatiques et dangereux dans l'eau potable.
Utilisation
Le méthanethiol est principalement utilisé comme odorant en tant qu'additif dans le propane et le gaz naturel, ces derniers gaz étant souvent inodores. L'odeur du méthanethiol permet de détecter une fuite, car il se vaporise très vite et se sent en très faibles quantités.
Dans le cas du propane, on ajoute le méthanethiol liquide au propane liquide lors de l'opération de raffinage. Le méthanethiol reste à la concentration désirée lorsque le propane est acheminé par pipe-line et stocké. Les cuves de propane sont en général conçues pour que ce soit du gaz et non pas du liquide qui sorte. Or le point d'ébullition du méthanethiol étant plus élevé que celui du propane (et sa pression de vapeur plus faible), il se concentre davantage dans la cuve tandis que celle-ci se vide. C'est pourquoi même des fuites d'une cuve presque vide émettent l'odeur caractéristique.
Dans le cas du gaz naturel, le méthanethiol est injecté dans le réseau de distribution, en général quelques kilomètres avant le point d'utilisation. Les équipements servant à injecter le méthanethiol ainsi que les bonbonnes se situent en général au compteur principal, à l'extérieur de beaucoup de villes.
À cause de sa réactivité, il arrive que le méthanethiol parte du gaz avant de pouvoir atteindre le point d'utilisation, ou après une fuite. Il peut en effet réagir avec les métaux des tuyaux, notamment quand ceux-ci sont corrodés, et peut s'agglutiner aux poussières. Il y a déjà eu des explosions lors de fuites souterraines non détectées, car le méthanethiol du gaz avait été filtré par la terre.
Le méthanethiol est également utilisé dans l'industrie des polymères, ainsi qu'en tant que précurseur dans la fabrication de pesticides. Il sert aussi comme additif dans les carburants des avions à réaction. Il est également produit par décomposition des produits boisés lors de la fabrication du papier.
Voir aussi
Notes et références
- ↑ a , b , c , d , e , f et g METHYLMERCAPTAN, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « methanethiol » sur ESIS, consulté le 15 février 2009
- ↑ « Méthylmercaptan » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique extrêmement inflammable | Produit chimique dangereux pour l'environnement | Thiol
Wikimedia Foundation. 2010.

