- C3Cl3N3
-
Chlorure cyanurique
Chlorure cyanurique 
Général Nom IUPAC 2,4,6-trichloro-1,3,5-triazine Synonymes trichlorotriazine
Chlorure de cyanuryleNo CAS No EINECS PubChem Apparence poudre cristalline blanche Propriétés chimiques Formule brute C3Cl3N3 [Isomères] Masse molaire 184,411 g∙mol-1
C 19,54 %, Cl 57,67 %, N 22,79 %,Propriétés physiques T° fusion 146 °C[1] T° ébullition 194 °C[1] Solubilité décomposition violente dans l'eau[1] Masse volumique 1 92 g∙cm-3 à 20 °C[1] T° d’auto-inflammation > 650 °C[1] Point d’éclair > 190 °C[1] Pression de vapeur saturante 0,025 mbar à 20 °C
2,7 mbar à 70 °C[1]Précautions Directive 67/548/EEC 
T+
CPhrases R : 14, 22, 26, 34, 43, Phrases S : (1/2), 26, 28, 36/37/39, 45, 46, 63, Transport 80 2670 NFPA 704 Écotoxicologie DL50 10mg/kg (souris, i.p.)
18mg/kg (souris, i.v.)
350mg/kg (souris, oral)Unités du SI & CNTP, sauf indication contraire. Le chlorure cyanurique est un composé chimique de formule (NCCl)3. C'est un dérivé chloré de la 1,3,5-triazine. C'est un trimère du chlorure de cyanogène[2].
Sommaire
Propriétés
Le chlorure cyanurique se présente sous le forme d'une poudre cristalline blanche à l'odeur de dichlore ou d'acide chlorhydrique. À l'air sec, même par température élevée il est stable, mais dès la présence d'humidité, il s'hydrolyse en acide cyanurique et de acide chlorhydrique. La vitesse de cette hydrolyse dépend fortement de la température et de pH. Dans une solution tamponnée à pH = 7 d'eau glacée, il est stable pendant plusieurs heures, mais dès que la température dépasse 10 °C l'hydrolyse se produit, d'autant pus rapidement que la température augmente, aidée par le fait qu'elle est autocatalysée par l'acide chlorhydrique.
Synthèse
Le chlorure cyanurique est préparé en deux étapes.
- La première étape est la chloration du cyanure d'hydrogène en chlorure de cyanogène
- HCN + Cl2 → ClCN + HCl
- la deuxième étape consiste en la trimérisation du chlorure de cyanogène en chlorure cyanurique
- 3 ClCN → (ClCN)3
En 2005, approximativement 200 000 tonnes de chlorure cyanurique furent produites[3].
Utilisation
Pesticides, colorants
Environ 70% du chlorure cyanurique sert à synthétiser des pesticides de la classe des triazines, en particulier l'atrazine. Ces réactions reposent sur la bonne labilité des atomes de chlore, substitués par des amines:
- (ClCN)3 + RNH2 → (RNHCN)(ClCN)2 + RNH3+Cl-
Le chlorure cyanurique est aussi utilisé comme précurseur de colorants et d'agents de réticulation. La plus grande classe de colorants concernés sont les triazines-stilbènes sulfonatés utilisés comme agents azurants[3].
Synthèse organique
Le chlorure cyanurique est utilisé comme réactif pour convertir les alcools et les acides carboxyliques en respectivement chlorure d'alkyle et chlorure d'acyle[4] :
Il est aussi utilisé comme déshydratant at pour "activer" les acides carboxyliques afin de les réduire en alcools. Lorsqu'il et chauffé en présence de diméthylformamide (DMF) on obtient le réactif de Gold, Me2NCH=NCH=NMe2+Cl-, une source polyvalente pour les aminalkylations et un précurseur d'hétérocycles[5][6].
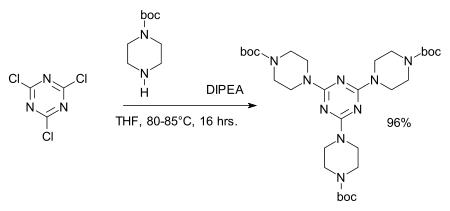
Les atomes de chlore du chlorure cyanurique sont facilement remplaçable par des amines pour former par exemple la mélamine qui peut à son tour être utilisée dans la synthèses de dendrimères[7][8]:
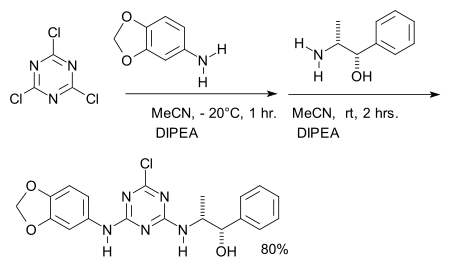
ou dans la synthèse de ligands récepteurs d'adénosine expérimentaux[9]:
Notes et références
- ↑ a , b , c , d , e , f et g Entrée du numéro CAS « 108-77-0 » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 01/08/09 (JavaScript nécessaire)
- ↑ Cyanuric chloride at Chemicalland21.com
- ↑ a et b Klaus Huthmacher, Dieter Most "Cyanuric Acid and Cyanuric Chloride" Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. (ISBN 14356007-08)
- ↑ K. Venkataraman, and D. R. Wagle, « Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides », dans Tet. Lett., vol. 20, no 32, 1979, p. 3037–3040 [lien DOI]
- ↑ Probst, D. A.; Hanson, P. R.; Barda, D. A. "Cyanuric Chloride" in Encyclopedia of Reagents for Organic Synthesis, 2004, John Wiley & Sons. DOI:10.1002/047084289X.rn00320
- ↑ John T. Gupton; Steven A. Andrews (1990). "β-Dimethylaminomethylenation: N,N-Dimethyl-N'-p-tolylformamidine". Org. Synth.; Coll. Vol. 7: 197.
- ↑ Abdellatif Chouai and Eric E. Simanek, « Kilogram-Scale Synthesis of a Second-Generation Dendrimer Based on 1,3,5-Triazine Using Green and Industrially Compatible Methods with a Single Chromatographic Step », dans J. Org. Chem., vol. 73, 2008, p. 2357-2366 [lien DOI]
- ↑ Reagent: DIPEA, amine protective group: BOC
- ↑ Modèle:Ref patent (Reagent number two: norephedrine, base DIPEA)
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Cyanuric chloride ».
- Portail de la chimie
Catégories : Produit chimique très toxique | Produit chimique corrosif | Produit chimique qui réagit avec l'eau | Triazine | Composé organo-chloré
Wikimedia Foundation. 2010.