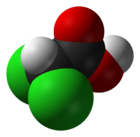
- C2H2Cl2O2
-
Acide dichloroacétique
Acide dichloroacétique 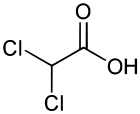
Structure de l'acide dichloroacétique. Général Nom IUPAC Acide dichloroéthanoïque No CAS No EINECS Apparence liquide incolore, d'odeur âcre.[1] Propriétés chimiques Formule brute C2H2Cl2O2 [Isomères] Masse molaire 128,942 g∙mol-1
C 18,63 %, H 1,56 %, Cl 54,99 %, O 24,82 %,pKa 1,25 Propriétés physiques T° fusion 13,5 °C[1] T° ébullition 194 °C[1] Solubilité dans l'eau : miscible Masse volumique (eau = 1) : 1.56[1] Pression de vapeur saturante à 20 °C : 19 Pa[1] Précautions Directive 67/548/EEC 
C
NPhrases R : 35, 50, Phrases S : (1/2), 26, 45, 61, Transport - 1764 SIMDUT[3] 

SGH[4] 

DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[2] Écotoxicologie LogP 0.92[1] Unités du SI & CNTP, sauf indication contraire. L’acide dichloroacétique (ou acide dichloroéthanoïque) a la structure de l’acide acétique auquel on aurait substitué deux des trois atomes d’hydrogène du groupe méthylique par des atomes de chlore (CHCl2COOH). Il est préparé par la réduction d'acide trichloracétique.
Sommaire
Chimie
La chimie de l'acide dichloroacétique est étroitement liée à celle des acides organiques halogénés. C'est un membre de la famille des acides chloroacétiques. L'ion dichloroacétate est produit dès la dissolution dans l'eau. Il s'agit d'un acide fort avec un pKa de 1,3, et qui est très corrosif et extrêmement destructeur des tissus des muqueuses et des voies respiratoires supérieures.
Usage thérapeutique
Acidose lactique
L’ion dichloroacétate stimule l'activité de l'enzyme pyruvate déshydrogénase en inhibant l'enzyme kinase de déshydrogénase de pyruvate. Ainsi, il diminue la production de lactate en décalant le métabolisme du pyruvate de glycolyse vers l'oxydation dans les mitochondries. Cette propriété a été employée pour traiter l’acidose lactique chez les humains.
Cancer
Dans des expériences récentes à l’université d'Alberta, le dichloroacétate a été également utilisé pour régler et reconstituer des fonctions métaboliques normales dans des mitochondries endormies par le cancer. Ceci est particulièrement intéressant dans les cellules cancéreuses, qui ne se détruisent pas par elles-mêmes (apoptose) dues aux fonctions métaboliques endommagées. Des doses minimes de dichloroacétate ont réduit des cancers du sein, des tumeurs cérébrales, et des cancers du poumon sur des cellules humaines et chez le rat. Bien que ceci indique que l'acide dichloroacétiquee pourrait être à terme employé en thérapie humaine contre le cancer, aucun test clinique n'a été réalisé sur des patients.
Effets secondaires
L’utilisation thérapeutique du dichloroacétate peut causer des douleurs, des engourdissements et perturber la marche.
Le dichloroacétate peut également avoir des effets anxiolytiques ou sédatifs.
Références
- ↑ a , b , c , d , e et f ACIDE DICHLOROACETIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Acide dichloroacétique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Liens externes
- Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique dangereux pour l'environnement | Acide carboxylique
Wikimedia Foundation. 2010.