- Lactate
-
Acide lactique
Acide lactique 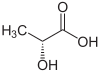
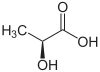
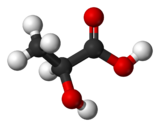
Formule semi-développée et structure tri-dimensionnelle de de l'acide lactique Général Nom IUPAC acide 2-hydroxypropanoïque No CAS
(RS)
(S+ ou L)
(R- ou D)No EINECS
(RS)
(S)
(R)No E E270 FEMA SMILES Apparence liquide incolore à jaune visqueux ou cristaux incolores à jaunes. (DL)[1] Propriétés chimiques Formule brute C3H6O3 [Isomères] Masse molaire 90,0779 g∙mol-1
C 40 %, H 6,71 %, O 53,29 %,pKa 3,8 Propriétés physiques T° fusion L: 53 °C
D: 53 °C
D/L: 16,8 °CT° ébullition 122 °C à 12 mmHg Solubilité dans l'eau : miscible (DL)[1] Masse volumique (eau = 1) : 1.2 (DL)[1] Point d’éclair 110 °C (c.f.) (DL)[1] Propriétés optiques Pouvoir rotatoire 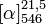 -2,6° (8 g/100ml, R)[2]
-2,6° (8 g/100ml, R)[2]
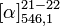 +2,6° (2,5 g/100ml, S)[2]
+2,6° (2,5 g/100ml, S)[2]Précautions SIMDUT[3],[4] Acide lactique :
Produit non classifié
Acide lactique, (dl-) :
Unités du SI & CNTP, sauf indication contraire. L'acide lactique est un acide organique qui joue un rôle dans divers processus biochimiques. Un lactate est un sel de cet acide.
L'acide lactique est un acide carboxylique, sa formule chimique est C3H6O3 et sa structure se réflète dans son nom systématique, l'acide 2-hydroxy-propanoïque. Comme il possède un carbone asymétrique, il existe deux énantiomères de l'acide lactique.
Sommaire
Chimie
Sa masse molaire est de 90g/mol.
En solution, le groupe carboxyle -COOH peut perdre un proton, donnant un ion lactate : CH3CHOHCOO-.
L'acide lactique est soluble dans l'eau et considéré comme un acide faible (pKa=3,90), c'est-à-dire que la réaction de dissociation dans l'eau n'est pas totale :
CH3CHOHCOOH + H2O ⇄ CH3CHOHCOO- + H3O+
1 mole libère 1 équivalent H+.
On trouve donc à la fois en solution l'acide lactique et sa forme basique, l'ion lactate, en proportions variables selon le pH.
Effort musculaire et fermentation lactique
Le lactate est l'un des produits clé de la production d'énergie dans les muscles notamment. La respiration cellulaire (consommation de sucres en vue de produire de l'énergie) peut être décomposée en deux grandes étapes, la première est la glycolyse, la partie cytoplasmique du processus, qui peut fonctionner en l'absence de dioxygène. Elle fournit de l'acide pyruvique qui alimente la seconde partie, mitochondriale, de la respiration cellulaire (cycle de Krebs et phosphorylation oxydative) qui aboutit à la réduction du dioxygène en eau. A un bout de la chaîne, du glucose est oxydé, et à l'autre, du dioxygène est réduit. L'énergie dégagée est récupérée par la cellule.
Si l'apport en oxygène est supérieur à la consommation de sucre, alors la totalité de l'acide pyruvique produit est immédiatement consommée dans la partie mitochondriale.
Si la consommation de sucre devient supérieure à l'apport en oxygène (efforts intenses) alors une partie de l'acide pyruvique produit en première partie de processus est réduite en acide lactique, ce qui permet au cycle oxydatif de la glycolyse de continuer. C'est une fermentation. La partie mitochondriale est ralentie, voire stoppée et le rendement énergétique s'en trouve très diminué.
L'acide lactique s'accumule dans la cellule, puis passe la membrane cellulaire pour se retrouver dans la circulation sanguine. Le foie le recycle finalement en acide pyruvique.
Fermentation bactérienne
Il existe 2 grands types de fermentation bactérienne qui produisent de l'acide lactique : dans le vin et les produits laitiers.
- Dans le vin, il s'agit de la fermentation malolactique : l'acide malique, naturellement contenu dans le vin, est dégradé en acide lactique sous l'action des bactéries.
- Dans le lait et les produits laitiers, l'acide lactique provient de la dégradation du lactose par les bactéries. Plus un lait est frais, moins il contient d'acide lactique. La concentration en acide lactique dans un lait s'exprime en degré Dornic (°D) : 1°D correspond à 0,1 g d'acide lactique par litre de lait. Un lait frais contient de 15 à 18°D, il caille à 60-70°D.
Les organismes responsables de l'apparition d'acide lactique sont les lactobacilles. Lorsqu'elles opèrent dans la bouche, l'acide lactique produit peut entraîner des caries.
Utilisations
L'acide lactique est utilisé dans l'industrie alimentaire comme additif (E270) en tant qu'antioxygène, acidifiant ou exhausteur de goût. L’acide lactique se présente aussi sous forme de sels : sel de sodium (E325), de potassium (E326) et calcium (E327). Ses sels sont sous formes de poudre et sont également solubles dans l’eau[5]. Il agit comme agent bactériostatique notamment sur des bactéries pathogènes comme la salmonelle (ou la listeria) et aussi un effet dépresseur d’activité de l'eau[5].
Une autre utilisation méconnue concerne le pouvoir instantané de l'acide lactique dans le traitement de la douleur liée aux aphtes buccaux. Un simple contact avec un coton-tige imbibé d'acide lactique blanchit l'aphte et calme immédiatement la douleur. On peut se procurer de l'acide lactique dans certaines pharmacies. D'après des recherches ayant eu lieu au Québec[6], il semblerait que l'acide lactique soit un des moyens les plus naturels pour prévenir le cancer de la vessie; mais aussi celui de la peau.
Historique
L'acide lactique a été découvert par Charles Guillaume Scheele (1742-1786).
Références et notes
- ↑ a , b , c et d ACIDE LACTIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a et b (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman, Susan Budavari, The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals, 13th edition, MERCK & CO INC, 2001, 2564 p. (ISBN 0911910131)
- ↑ « Acide lactique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ « Acide lactique, (dl-) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ a et b [pdf] C Chêne (2002) les acides organiques Centre de Ressources Technologiques pour les Entreprises Agro-Alimentaires. www.adrianor.com.
- ↑ http://sante.canoe.com/channel_health_news_details.asp?channel_id=2001&relation_id=3483&news_channel_id=2001&news_id=3695
Voir aussi
Articles connexes
- Additif alimentaire
- Arôme
- Lait et vin
- Acide polylactique Plastique biodégradable
Liens externes
- Portail de la biologie
- Portail de la chimie
Catégories : Produit chimique corrosif | Acide carboxylique | Vocabulaire sportif | Entraînement sportif | Saveur acide | Alcool (chimie) | Exhausteur de goût | Régulateur alimentaire de pH
Wikimedia Foundation. 2010.
