- Carbure de lithium
-
Carbure de lithium 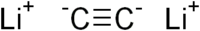
Général Nom IUPAC éthylure de lithium Synonymes acétylure de dilithium, acétylure de lithium, 2-lithio-éthynyllithium No CAS Propriétés chimiques Formule brute C2Li2 [Isomères] Masse molaire[1] 37,903 ± 0,006 g·mol-1
C 63,38 %, Li 36,63 %,Propriétés physiques T° fusion >550 °C Masse volumique 1,3 g·cm-3[2] Unités du SI & CNTP, sauf indication contraire. Le carbure de lithium, Li2C2, souvent appelé acétylure de lithium ou de dilithium, est un composé chimique du lithium et du carbone. Li2C2 est l'un des nombreux composés lithium-carbone qui incluent les composés riches en lithium (Li4C, Li6C2, Li6C3, Li8C3, Li4C3, Li4C5) et les composés d'insertion du graphite LiC6, LiC12 et LiC18.
Le carbure de lithium est un carbure riche en lithium thermodynamiquement stable et c'est le seul d'entre eux qui peut être obtenu directement à partir de ses éléments. Il a été découvert en 1896 par Henri Moissan[3] qui l'a obtenu en faisant réagir du charbon et du carbonate de lithium. Les autres carbures riches en lithium sont produits par réaction entre des vapeurs de lithium et des hydrocarbures chlorés, par ex. CCl4. Le carbure de lithium est aussi un composé intermédiaire produit lors des procédures de datation au radiocarbone.
Sommaire
Structure
Li2C2 est un sel ionique, 2Li+.C22−. Il a une structure similaire au peroxyde de rubidium, Rb2O2 et au peroxyde de césium, Cs2O2. À haute température, la structure du carbure de lithium se transforme réversiblement en une structure cubique anti-fluorine[4].
Préparation et réacticité
Pour préparer des quantités pures, de ce composé en laboratoire, du lithium fondu et du graphite réagissent à haute température. Li2C2 peut aussi être préparé par réaction du CO2 sur du lithium fondu. Le carbure de lithium est réactif et s'hydrolyse très facilement pour former de l'éthyne (gaz), C2H2 et de l'hydroxyde de lithium, LiOH.
Utilisation pour la datation au radiocarbone
Il y a de nombreux types de procédure : certaines brûlent l'échantillon à analyser en produisant du CO2 qui réagit ensuite avec du lithium et d'autres où le carbone contenu dans l'échantillon réagit directement avec du lithium métallique[5]. Le résultat est le même, l'éthylure de lithium est produit qui est ensuite utilisé pour créer des espèces faciles à peser en spectrométrie de masse, comme l'éthyne ou le benzène[6]. Il faut noter que du nitrure de lithium peut être formé, ce qui produit de l'ammoniaque lors de l'hydrolyse et contamine l'acétylène.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lithium carbide » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- R. Juza; V. Wehle; H.-U. Schuster, Zur Kenntnis des Lithiumacetylids, Zeitschrift für anorganische und allgemeine Chemie, 1967, vol. 352, pp. 252. DOI:10.1002/zaac.19673520506
- H. Moissan, Comptes Rendus hebd. Séances Acad. Sci., 1896, vol. 122, p. 362.
- U. Ruschewitz, R. Pöttgen, Structural Phase Transition in Li2C2, Zeitschrift für anorganische und allgemeine Chemie, 1999, vol. 625(10), pp. 1599–1603. DOI:10.1002/(SICI)1521-3749(199910)625:10<1599::AID-ZAAC1599>3.0.CO;2-J.
- Swart E.R., The direct conversion of wood charcoal to lithium carbide in the production of acetylene for radiocarbon dating, Cellular and Molecular Life Sciences, 1964, vol. 20, p. 47. DOI:10.1007/BF02146038.
- (en) University of Zurich Radiocarbon Laboratory webpage
Wikimedia Foundation. 2010.
