N,N-diisopropyléthylamine
- N,N-diisopropyléthylamine
-
| N,N-diisopropyléthylamine |
|
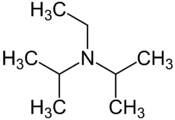
Structure de la diisopropyléthylamine |
| Général |
| Nom IUPAC |
N-éthyl-N-propan-2-ylpropan-2-amine |
| Synonymes |
DIPEA, base de Hünig, N-éthyldiisopropylamine |
| No CAS |
7087-68-5 |
| No EINECS |
230-392-0 |
| SMILES |
|
| InChI |
Std. InChI : Vue 3D
InChI= 1S/ C8H19N/ c1- 6- 9( 7( 2) 3) 8( 4) 5/ h7- 8H, 6H2, 1- 5H3
Std. InChIKey :
JGFZNNIVVJXRND- UHFFFAOYSA- N
|
| Propriétés chimiques |
| Formule brute |
C8H19N [Isomères]
|
| Masse molaire[1] |
129,2432 ± 0,0079 g·mol-1
C 74,35 %, H 14,82 %, N 10,84 %,
|
| Propriétés physiques |
| T° ébullition |
127 °C [2] |
| Masse volumique |
0,76 g·cm-3 à 20 °C [2] |
| Précautions |
|
Directive 67/548/EEC[2]
|

C
|

F
|
|
Symboles :
C : Corrosif
F : Facilement inflammable
Phrases R :
R11 : Facilement inflammable.
R22 : Nocif en cas d’ ingestion.
R34 : Provoque des brûlures.
R52/53 : Nocif pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l’ environnement aquatique.
Phrases S :
S16 : Conserver à l’ écart de toute flamme ou source d’ étincelles - Ne pas fumer.
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’ eau et consulter un spécialiste.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
S61 : Éviter le rejet dans l’ environnement. Consulter les instructions spéciales/ la fiche de données de sécurité.
S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/ du visage.
|
| Phrases R : 11, 22, 34, 52/53, |
| Phrases S : 16, 26, 36/37/39, 45, 61, |
|
Transport[2]
|
Code Kemler :
368 : matière liquide inflammable, toxique et corrosive
Numéro ONU :
3286 : LIQUIDE INFLAMMABLE, TOXIQUE, CORROSIF, N. S. A.
Classe :
3
Étiquettes :
 3 : Liquides inflammables
3 : Liquides inflammables
 6.1 : Matières toxiques
6.1 : Matières toxiques
 8 : Matières corrosives
Emballage :
Groupe d
8 : Matières corrosives
Emballage :
Groupe d' emballage I/ II : matières très/ moyennement dangereuses;
|
|
SGH[2]
|
  
Danger
H225, H301, H314, H412, P210, P273, P280, P301+P330+P331, P305+P351+P338,
H225 : Liquide et vapeurs très inflammables
H301 : Toxique en cas d'ingestion
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H412 : Nocif pour les organismes aquatiques, entraîne des effets à long terme
P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer.
P273 : Éviter le rejet dans l’environnement.
P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage.
P301+P330+P331 : EN CAS D’INGESTION: rincer la bouche. NE PAS faire vomir.
P305+P351+P338 : EN CAS DE CONTACT AVEC LES YEUX: rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer.
|
|
Unités du SI & CNTP, sauf indication contraire.
|
La N,N-diisopropyléthylamine, ou DIPEA, également appelée base de Hünig, est un composé chimique de formule (H3C)2CH–N(CH2–CH3)–CH(CH3)2.
C'est une amine tertiaire utilisée comme base en chimie organique. En raison de l'encombrement stérique autour de l'atome d'azote, lié à deux groupes isopropyle et un groupe éthyle, seul un proton H+ est assez petit pour venir s'y lier. La DIPEA est une base organique plutôt forte, cependant faiblement nucléophile, à l'image de la 2,2,6,6-tétraméthylpipéridine, ce qui en fait un réactif organique très utile.
On la prépare traditionnellement par réaction de la diisopropylamine avec le sulfate de diéthyle[3].
Notes et références
- ↑ Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- ↑ a, b, c, d et e Entrée de « N,N-Diisopropylethylamine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 juillet 2011 (JavaScript nécessaire)
- ↑ (de) Siegfried Hünig, Max Kiessel, « Spezifische Protonenacceptoren als Hilfsbasen bei Alkylierungs- und Dehydrohalogenierungsreaktionen », dans Chemische Berichte, vol. 91, no 2, février 1958, p. 380-392 [texte intégral (page consultée le 20 juillet 2011)] DOI:10.1002/cber.19580910223
Catégories : - Produit chimique corrosif
- Produit chimique facilement inflammable
- Produit chimique dangereux pour l'environnement
- Amine
- Base
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article N,N-diisopropyléthylamine de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
N,N-Diisopropylethylamine — IUPAC name Ethyldiisopropylamine … Wikipedia
DIEA — diisopropylethylamine … Medical dictionary
DIEA — • diisopropylethylamine … Dictionary of medical acronyms & abbreviations
Sonogashira coupling — In organic chemistry, a Sonogashira coupling is a coupling reaction of terminal alkynes with aryl or vinyl halides. This reaction was first reported by Kenkichi Sonogashira and Nobue Hagihara in 1975. [cite journal author = K. Sonogashira, Y.… … Wikipedia
Wender Taxol total synthesis — starting from a naturally occurring compound with ring construction in the order A,B,C,D. The Wender effort is shorter by approximately 10 steps. Raw materials for the preparation of Taxol by this route include verbenone, prenyl bromine, allyl… … Wikipedia
Swern oxidation — The Swern oxidation, named after Daniel Swern, is a chemical reaction whereby a primary or secondary alcohol is oxidized to an aldehyde or ketone using oxalyl chloride, dimethyl sulfoxide (DMSO) and an organic base, such as triethylamine. [cite… … Wikipedia
Aldol reaction — The aldol reaction is a powerful means of forming carbon–carbon bonds in organic chemistry.[1][2][3] Discovered independently by … Wikipedia
Peptide synthesis — In organic chemistry, peptide synthesis is the production of peptides, which are organic compounds in which multiple amino acids are linked via peptide bonds which are also known as amide bonds. The biological process of producing long peptides… … Wikipedia
Triethylamine — Triethylamine … Wikipedia
Azide alkyne Huisgen cycloaddition — The Azide Alkyne Huisgen Cycloaddition is a 1,3 dipolar cycloaddition between an azide and a terminal or internal alkyne to give a 1,2,3 triazole. Rolf Huisgen[1] was the first to understand the scope of this organic reaction. American chemist K … Wikipedia









