- Acide isocyanique
-
Acide isocyanique 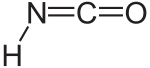
Général Nom IUPAC acide isocyanique No CAS PubChem ChEBI SMILES InChI Apparence liquide incolore ou gaz du fait de son bas p.e. Propriétés chimiques Formule brute CHNO [Isomères] Masse molaire[1] 43,0247 ± 0,0014 g·mol-1
C 27,92 %, H 2,34 %, N 32,56 %, O 37,19 %,Propriétés physiques T° fusion -86 °C[2],[3] T° ébullition 23,5 °C[2] Solubilité en toute proportion dans l'eau[2], soluble dans le benzène, le toluène, l'éther Masse volumique 1,14 g·cm-3 à 20 °C[2] Thermochimie S0gaz, 1 bar 238,22 J·K-1·mol-1 [4] ΔfH0gaz -101,67 kJ·mol-1 [4] Unités du SI & CNTP, sauf indication contraire. L’acide isocyanique est un acide de formule brute CHNO. C'est le tautomère de l'acide cyanique. Il est considéré comme un élément important dans la chimie de constitution d'éléments biochimiques jusqu’à l’apparition des premiers systèmes qualifiés de biologiques[réf. nécessaire].
Sommaire
Particularités
On peut considérer ce composé comme un ancêtre des premiers intervenants dans l'aboutissement, à terme, de cellules vivantes. Cette molécule à quatre atomes entre dans la liste de molécules détectées dans le milieu interstellaire. On a décelé des traces d'acide isocyanique (HN=C=O) dans la comètes Hyakutake en 1996 et la comète Hale-Bopp en 1997. Il a été démontré[5] que l'acide isocyanique pouvait servir d'agent d'activation des acides aminés.
Cette étude a ainsi montré que l'acide isocyanique et son précurseur l'urée, sont des agents efficaces d'activation d'acides aminés pour la formation d'oligopeptides (protéine résultant, dans le monde vivant, d'une traduction génétique composé de 10 acides aminés au plus).
Propriétés physico-chimiques
L'acide isocyanique est le tautomère le plus répandu, car contrairement à l'acide cyanique, il est stable à température ambiante[6]. L'acide se décompose dans l'eau par hydrolyse. Cette réaction est fortement dépendante de la température, du pH et la concentration du composé. Ainsi en solution légèrement acide, l'acide isocyanique se décompose rapidement en carbonate et ammonium, avec parfois la formation d'urée[6].
Utilisation
L'acide n'est pas utilisé sous sa forme protonée, mais comme sels tels l'isocyanate de potassium et l'isocyanate de sodium[6].
Notes
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter Verlag, 1995.
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002. (ISBN 978-0-07-049439-8).
- (en) « Isocyanic acid » sur NIST/WebBook, consulté le 17 février 2010
- Journal of the American Chemical Society, 2006, vol. 128, pp. 7412-7413.
- (en) Peter M. Schalke, Cyanates, Inorganic Salts, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », 15 juillet 2006
Wikimedia Foundation. 2010.


