- 8-hydroxyquinoléine
-
8-hydroxyquinoléine 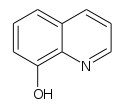
Structure de la 8-hydroxyquinoléineGénéral Nom IUPAC quinoléine-8-ol Synonymes 8-quinolinol, oxyquinoléine,
quinophénol, oxineNo CAS No EINECS PubChem ChEBI SMILES InChI Apparence cristaux incolores Propriétés chimiques Formule brute C9H7NO [Isomères] Masse molaire[1] 145,158 ± 0,0082 g·mol-1
C 74,47 %, H 4,86 %, N 9,65 %, O 11,02 %,Propriétés physiques T° fusion 76 °C T° ébullition 267 °C Masse volumique 1,03 g·cm-3 [2] Précautions Directive 67/548/EEC[2] 
XnPhrases R : 22, SGH[3] 
AttentionUnités du SI & CNTP, sauf indication contraire. La 8-hydroxyquinoléine est un composé organique de formule brute C9H7NO. Il s'agit d'un dérivé de la quinoléine, hydroxylé sur le carbone 8, qui se présente sous forme d'un solide à cristaux incolores d'usage très répandu comme chélateur, comme antiseptique, ou encore comme pesticide, sous un grand nombre de dénominations parallèles.
Applications
La 8-hydroxyquinoléine est un chélateur bidentate monoprotique formant des chélates avec les bases de Schiff dérivées du salicylaldéhyde, telles que le salicylaldoxime et le salen. En solution aqueuse à pH neutre, l'hydroxyle est protoné (pKa = 9,89) tandis que l'azote ne l'est pas (pKa = 5,13)[4], mais il existe un état excité dans lequel l'azote reçoit un proton de l'hydroxyle, donnant un zwitterion avec un anion d'oxygène et un cation d'azote protoné[5].
La 8-hydroxyquinoléine et ses chélates présentent des propriétés antiseptiques, désinfectantes et pesticides[6],[7].
La réaction de la 8-hydroxyquinoléine avec l'aluminium(III) conduisent au tris(8-hydroxyquinoléine)aluminium(III) (Alq3)[8], un composé couramment utilisé pour réaliser des diodes électroluminescentes organiques (OLED) dont les variations dans les substituants du noyau quinoléine permettent de moduler la luminescence[9].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « 8-Quinolinol » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 24 juin 2011 (JavaScript nécessaire)
- SIGMA ALDRICH
- (en) Adrien Albert et J. N. Phillips, « 264. Ionization constants of heterocyclic substances. Part II. Hydroxy-derivatives of nitrogenous six-membered ring-compounds », dans Journal of the Chemical Society, 1956, p. 1294-1304 [texte intégral (page consultée le 24 juin 2011)]
DOI:10.1039/JR9560001294 - (en) Elisabeth Bardez, Isabelle Devol, Bernadette Larrey et Bernard Valeur, « Excited-State Processes in 8-Hydroxyquinoline: Photoinduced Tautomerization and Solvation Effects », dans Journal of Physical Chemistry B, vol. 101, no 39, 1997, p. 7786-7793 [texte intégral (page consultée le 24 juin 2011)]
DOI:10.1021/jp971293u - (en) J. P. Phillips, « The Reactions of 8-Quinolinol », dans Chemical Reviews, vol. 56, 1956, p. 271 [lien DOI]
- (en) Dictionnaire médical en ligne
- (en) Ryo Katakura et Yoshihiro Koide, « Configuration-Specific Synthesis of the Facial and Meridional Isomers of Tris(8-hydroxyquinolinate)aluminum (Alq3) », dans Inorganic Chemistry, vol. 45, no 15, 30 juin 2006, p. 5730-5732 [texte intégral (page consultée le 24 juin 2011)]
DOI:10.1021/ic060594s - (en) Victor A. Montes, Dr. Radek Pohl, Prof. Joseph Shinar, Prof. Pavel Anzenbacher Jr., « Effective Manipulation of the Electronic Effects and Its Influence on the Emission of 5-Substituted Tris(8-quinolinolate)Aluminum(III) Complexes », dans Chemistry – A European Journal, vol. 12, no 17, 2 juin 2006, p. 4523-4535 [texte intégral (page consultée le 24 juin 2011)]
DOI:10.1002/chem.200501403
Wikimedia Foundation. 2010.
