- Trichloréthylène
-
Trichloréthylène 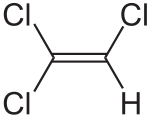
Général Synonymes 1,1,2-Trichloroéthylène
Trichloroéthène
Trichlorure d'acétylène
Trichlorure d'éthylèneNo CAS No EINECS PubChem SMILES InChI Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C2HCl3 [Isomères] Masse molaire[3] 131,388 ± 0,008 g·mol-1
C 18,28 %, H 0,77 %, Cl 80,95 %,Moment dipolaire 0,80 D [2] Diamètre moléculaire 0,529 nm [2] Propriétés physiques T° fusion -73 °C[1] T° ébullition 87 °C[1] Solubilité dans l'eau à 20 °C : 1 g·l-1[1] Masse volumique 1,5 g·cm-3[1],
Vapeurs plus denses que l'airT° d'auto-inflammation 410 °C[1] Limites d’explosivité dans l’air 8–10,5 %vol[1] Pression de vapeur saturante à 20 °C : 7,8 kPa[1] Point critique 50,5 bar, 298,85 °C [4] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 9,46 ± 0,02 eV (gaz)[6] Propriétés optiques Indice de réfraction  1,475 [2]
1,475 [2]Précautions Directive 67/548/EEC 
TPhrases R : 36/38, 45, 52/53, 67, Phrases S : 45, 53, 61, [7] Transport 60 1710 NFPA 704 SIMDUT[9] 
SGH[10] 
DangerClassification du CIRC Groupe 2A : Probablement cancérogène pour l'homme[8] Inhalation amener à l'air frais, éventuellement réanimation cardiopulmonaire Peau enlever les vêtements souillés, laver à grande eau, montrer à un médecin Yeux laver à grande eau en maintenant les paupières ouvertes, montrer à un ophtalmologiste Ingestion ne pas faire boire, ne pas faire vomir, contacter un médecin. Écotoxicologie LogP 2,42[1] Seuil de l’odorat bas : 0,5 ppm
haut : 167 ppm[11]Unités du SI & CNTP, sauf indication contraire. Le trichloréthylène (ou trichloroéthylène) est un composé organique de formule brute C2HCl3 et de formule semi-développée ClCH=CCl2.
Il est également appelé trichloréthène (ou trichloroéthène), trichlorure d'éthylène ou d'éthène, trilène ou tout simplement trichlo ou trichlore.
Il s'agit d'une molécule d'éthène dont trois atomes d'hydrogène ont été remplacés par des atomes de chlore.
Sommaire
Dangers et précautions d'emploi
En 1995, le trichloréthylène a été classé « carcinogène[12] probable » (il était auparavant classé « carcinogène possible ») par l'International Agency for Research on Cancer (IARC). Ceci a été entériné par la directive européenne 2001/59/CE de la Commission du 6 août 2001 portant vingt-huitième adaptation au progrès technique de la directive 67/548/CEE.
Il irrite la peau et les muqueuses, et est un toxique pour le système nerveux central : inhalé à de fortes teneurs (au-delà de 3 000 ppm), il peut entraîner le coma voire la mort en quelques minutes. De nombreux cas de maladie professionnelle ont été rapportés suite à une manipulation prolongée.
En présence de flamme ou a une température supérieure à 120 °C il peut se décomposer en trois gaz extrêmement toxiques:
- monoxyde de carbone CO,
- chlorure d'hydrogène HCl,
- dichlore Cl2
S'il est lui-même non combustible, en revanche, ses vapeurs peuvent être explosives si elles se mélangent avec l'air (elles sont plus lourdes que l'air). L'eau ainsi que certains métaux (aluminium) provoquent la décomposition du trichloréthylène avec production d'acide chlorhydrique. L'acide chlorhydrique peut être neutralisé par ajout de stabilisants.
Il doit être stocké dans un endroit bien ventilé, avec une température comprise entre 15 °C et 25 °C. Il doit être manipulé en milieu bien ventilé, avec des gants et des lunettes de protection. L'INRS préconise l'utilisation de gants en PVA (alcool polyvinylique). En cas d'exposition accidentelle de la peau et des muqueuses, il faut enlever les vêtements souillés, laver abondamment à l'eau et consulter un médecin.
Selon la réglementation européenne, son utilisation est interdite pour les particuliers à une concentration supérieure à 0,1 %. Dans l'industrie, il faut procéder si possible à son remplacement par d'autres produits comme le tétrachloroéthylène (ou perchloroéthylène), le chlorure de méthylène (ou dichlorométhane (DCM)), d'autres dérivés d'’hydrocarbures (cétones, alcools,…), ou par certains fluoroalcanes.
Le trichloroéthylène est nocif pour la santé s’il est ingéré. Il cause une sensation de brûlure dans la bouche et la gorge, suivie de douleurs abdominales et des signes et des symptômes de dépression du système nerveux central. L'ingestion accidentelle de 30 mL à 500 mL (de 2 cuillères à table à 16 onces) cause un affaiblissement musculaire, des vomissements et la perte de conscience ou le délire, mais la victime récupère dans les deux semaines. Aucun effet n'a été signalé sur le cœur, le foie et les reins. Dans un cas seulement, l'ingestion de moins de 50 mL s'est avérée fatale à la suite d'une insuffisance rénale et hépatique. Certains des effets nocifs décrits par exemple les effets sur le foie, peuvent être dus à d'autres substances chimiques (stabilisants) ajoutées au trichloroéthylène[13]. La concentration maximale acceptable dans l’eau potable pour le TCE est de 0,005 mg·l-1[14].
Utilisation
Les deux principales caractéristiques intéressantes du trichloréthylène sont :
- qu'il s'agit d'un solvant ;
- que contrairement à la plupart des solvants, il est peu inflammable.
Il a beaucoup été utilisé pour le dégraissage de pièces métalliques, le nettoyage à sec de vêtements et l'extraction de produits organiques. Il fut utilisé comme anesthésiant sous le nom trilène.
Il tend à être progressivement remplacé par des produits moins dangereux, et est d'ores et déjà interdit pour les particuliers dans l'Union européenne.
Le trichloroéthylène sert surtout au dégraissage à la vapeur des pièces métalliques dans les industries de l'automobile et des métaux. Il sert aussi de composante d'adhésifs et de solvant dans les décapants à peinture, les lubrifiants, les peintures, les vernis, les pesticides, les nettoyeurs à froid pour métaux, les caoutchoucs et les élastomères. Il est utilisé comme caloporteur à basse température et comme intermédiaire chimique dans la production de produits pharmaceutiques, d'agents chimiques ignifuges et d'insecticides. Il est utilisé dans la phosphatation des métaux, la transformation des textiles, la production de chlorure de vinyle et les opérations aérospatiales[15].
Le trichloréthylène passe en catégorie 2 des substances cancérogènes (Directive de l'Union Européenne sur les substances dangereuses) avec la phrase de risque R45 "peut causer le cancer". C'est ce qu'ont décidé les Experts Européens lors de la réunion (28ème Adaptation au Progrès Technique) du 25 janvier 2001, confirmant ainsi la recommandation du groupe de travail de l'Union Européenne, chargé de la classification, de l'emballage et de l'étiquetage. Rappelons que le trichloréthylène était en catégorie 3 des cancérogènes, étiqueté R40 "Effet cancérogène suspecté-preuves insuffisantes".
Contamination au TCE
Les eaux souterraines constituent la seule source d'eau pour 25 à 30 % de la population canadienne, c’est-à-dire 7,1 million de Canadiens[16]. La municipalité de Shannon, municipalité de la province de Québec (Canada) réalise des analyses et remarque que la nappe phréatique est contaminée par du trichloréthylène (TCE), ce qui cause une augmentation des cancers dans cette région. Les gens de la ville ont décidé d'intenter un recours collectif contre le gouvernement du Canada car celui-ci connaissait le problème depuis 30 ans[17] .
Un cluster de cancer (leucémie et autres), impliquant des composés organiques volatiles dégagés par une entreprise de nettoyage à sec, dont du trichloréthylène, du 1,2-dichloroéthylène, du perchloroéthylène, du dichlorométhane et du chlorure de vinyle, a été découvert à Camp Lejeune, en Caroline du Nord[18].
Certains végétaux, dont plantes trouvées dans les jardins [19] se montre capable d’absorber de grandes quantités de polluants organiques[20] et parfois de les dégrader, en disposant par exemple de mécanismes de détoxication face au trichloroéthylène qui est toxique et génotoxique [21]. Le peuplier en fait partie.
Dépollution
La fongoremédiation est une des solutions étudiées. la Phytoépuration en est une autre, potentiellement complémentaire : Le peuplier pouvait avoir un potentiel supplémentaire en matière de phytoépuration des sols in situ (d’autres essences pourraient aussi peut-être avoir une telle aptitude).[22]
Des tests faits dans les années 1990 avec des peupliers hybrides (Populus trichocarpa x P. deltoides ; clones H1-11 and 50-189[23], plantés dans un sol irrigué par une eau volontairement polluée par du trichloréthylène[23]) ont montré que ces peupliers absorbaient du TCE et en dégradaient une partie en plusieurs déchets métaboliques connus : trichloroéthanol, acide trichloracétique et acide dichloracétique).[22]. Une autre partie (moins de 5 % lors d’une des expériences, mais ce taux pourrait être différent dans la nature [24]) était évacuée via l’évapotranspiration (« phytovolatilization », habituellement mesurée en culture sous serre), en quantités mesurables. Il s’agit bien d’une biodégradation qui ne résulte pas de l’activité de bactéries de la rhizosphère ou de symbiotes fongiques du peuplier (qui existe aussi par ailleurs pour un certain nombre de polluants [25]), car en laboratoire des cultures pures de cellules de peupliers dégradent effectivement le trichloréthylène, en produisant les mêmes produits métaboliques intermédiaires[22], et quand on les a exposé à du trichloréthylène marqué au radiocarbone 14 (traceur[26]), ces cultures cellulaires ont aussi produit du dioxyde de carbone radiomarqué ce qui montre qu’il y a bien eu dégradation du trichloroéthylène au niveau cellulaire[22]. Des boutures de peupliers plantées dans un sol pollué par le TCE ont produit les mêmes métabolites. Le degré d’oxygénation de la rhizosphère semble avoir peu d’importance[24].
L’extraction augmente avec l’évapotranspiration (indice métabolique) et n’est donc efficace que durant la saison de croissance, mais avec semble-t-il un très bon rendement : « au moins 95% du TCE supprimés » pour le TCE solubilisé dans le flux d'eau entrant dans les cellules des arbres [23].
Il faut néanmoins que le TCE soit assez dilué, car il est toxique pour les cellules du peuplier, qu’il tue au dessus d’une certaine dose[23] .Dosage du trichloroéthylène
Le trichloroéthylène est un contaminant émergeant problématique pour l’environnement, la faune et l’humain. Il est issu de l’activité industrielle de l’homme et s’accumule dans la nature peu à peu causant des dommages importants. L’accumulation du trichloroéthylène dans les eaux des nappes phréatiques est un des principaux problèmes touchant les eaux potables souterraines des petites municipalités[réf. nécessaire]. C’est pourquoi il est important de doser le trichloroéthylène dans les eaux souterraines. Pour doser le trichloroéthylène dans l’eau, on peu utiliser une technique d’analyse telle la chromatographie gazeuse couplée à un spectromètre de masse avec un ratio isotope (GC-MSIR)[27].
Avant l’analyse, les échantillons d’eau souterraine ont été conservés à 4 °C dans des contenants de verre scellés avec du téflon. Pour doser le trichloroéthylène, on utilise d’abord une pompe à extraction offline qui a pour rôle de préconcentrer l’analyte volatil organique.
D’abord, l’échantillon de 500 ml contenu dans le contenant d’échantillon en acier inoxydable est transféré vers le contenant d’extraction en acier inoxydable en ouvrant la valve (V1)[27]. Ensuite, le contenant d’extraction est brassé mécaniquement à une vitesse de 120 tours par minute. La valve (V2) est ouverte et le composé volatil organique, le trichloroéthylène, passe par un tuyau d’acier inoxydable chauffé à 50 °C pour éviter la condensation de vapeur d’eau durant l’extraction. Le montage entier est en acier inoxydable pour éviter l’adsorption du composé organique. Ensuite, un système à quatre capillaires est utilisé (C), pour éviter la rétro-diffusion du composé[27]. À ce point, la vapeur d’eau et le trichloroéthylène se retrouvent emprisonnés dans les trappes (T1 et T2) qui sont refroidies à l’azote liquide à -196 °C. La première trappe (T1) est plongée à 50 % dans l’azote liquide, tandis que la deuxième trappe (T2) est plongée à 100 % dans l’azote liquide. La justification est que, lorsque les deux trappes sont entièrement submergées, l’efficacité de l’extraction est diminuée de 50 %, car les vapeurs d’eau gèlent et bloquent le flux de vapeur)[27]. Sur 500 ml de l’échantillon d’eau souterraine seulement, 0,4 ml est emprisonné dans la trappe (T1) et c’est dans ce volume qu’est renfermé le composé organique volatil le trichloroéthylène. Sachant que le composé se retrouve presque entièrement emprisonné dans la première trappe, la deuxième trappe ne s’avère pas essentielle pour l’extraction. La trappe (T1) qui contient l’analyte préconcentré est conservée et branchée sur le système d’analyse P&T-GC-MSIR. L’analyte est chauffé à 250 °C pour une minute et est désorbé thermiquement du P&T et envoyé par un flux d’hélium vers une cellule cryogénique à -120 °C. Par la suite, la cellule cryogénique est chauffée et l’hélium envoi l’analyte vers le GC pour faire la séparation chromatographique)[27]. La séparation se fait à une température de 40 °C pendant 2 minutes, 50 °C à un rythme de 2 °C/minute, 50 °C pour 4 minutes, 100 °C à un rythme de 8 °C/minute, 100 °C pour 2 minutes, 210 °C à un rythme de 40 °C/minute et finalement 210 °C pour 3,5 minutes[28]. Une fois les composés organiques séparés, ils sont analysés par MSIR. Avec le spectromètre de masse avec ratio isotope, on peut déterminer la signature isotopique du trichloroéthylène. Il permet de déterminer l’abondance du 13C et du 12C avec le ratio 13C / 12C. En utilisant la technique de pompe à extraction, le pourcentage de recouvrement varie entre 80 et 110 % (4). La limite de quantification était de 1,4 μg·l-1 pour le P&T et s’est abaissée à 0,24 μg·l-1[27] en combinant avec la pompe à extraction.
Notes et références
- TRICHLOROETHYLENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8, ISBN 0-88415-858-6, ISBN 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- ESIS. Consulté le 1er février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2A : Probablement cancérogènes pour l'homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Trichloréthylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Trichloroethylene sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- carcinogène : qui peut donner le cancer (synonymes : cancérigène, cancérogène)
- Centre Canadien d’hygiène et de sécurité au travail (1998). Trichloroéthylène. Effet du trichloroéthylène sur la santé./chemicals/chem_profiles/trichloroethylene/.Dernier accès 23 mars 2010
- Santé Canada (2009). Recommandation pour l’eau potable au Canada. Le trichloroéthylène.Page 2 - Recommandations pour la qualité de l'eau potable au Canada : documentation à l'appui : Le trichloroéthylène
- Centre Canadien d’hygiène et de sécurité au travail (1998). Trichloroéthylène. Effet du trichloroéthylène sur la santé. /chemicals/chem_profiles/trichloroethylene/. Dernier accès 23 mars 2010
- Santé Canada (2009). Recommandation pour l’eau potable au Canada. Le trichloroéthylène. Page 2 - Recommandations pour la qualité de l'eau potable au Canada : documentation à l'appui : Le trichloroéthylène. Dernier accès 23 mars 2010
- Cancers à Shannon: une histoire d'eau, Enquète de Radio-Canada.ca Radio-Canada - Reportage: Cancers à Shannon
- Agency for Toxic Substances and Disease Registry (ATSDR), Survey of Childhood Cancers and Birth Defects at USMC Camp Lejeune (Full Report), juillet 2003.
- Schnabel WE, Dietz AC, Burken JG, Schnoor JL, Alvarez PJ. 1997. Uptake and transformation of trichloroethylene by edible garden plants. Water Res 31:816–824.
- Schroll R, Bierling B, Cao G, Do¨ rfler U, Lahaniati M, Langenbach T, Scheunert I, Winkler R. 1994. « Uptake pathways of organic chemicals from soil by agricultural plants”. Chemosphere 28:297–303
- Dekant W. New Concepts and Developments in Toxicology. In: Metabolic Conversion of Tri- and tetrachloroethylene : Formation and Deactivation of Genotoxic Intermediates (Chambes PL, Gehring P, Sakai F, eds). Amsterdam:Elsevier Science, 1986;211-221.
- Lee A. Newman, Stuart E. Strand, Nami Choe, James Duffy,‖ Gordon Ekuan, Martin Ruszaj,‖ B. Brook Shurtleff, Jodi Wilmoth, Paul Heilman, and Milton P. Gordon, « Uptake and Biotransformation of Trichloroethylene by Hybrid Poplars » ; Environ. Sci. Technol., 1997, 31 (4), pp 1062–1067 DOI: 10.1021/es960564w 1997-03-27 (Résumé)
- M Gordon, N Choe, J Duffy, G Ekuan, P Heilman, I Muiznieks, M Ruszaj, B B Shurtleff, S Strand, J Wilmoth, and L A Newman, « Phytoremediation of trichloroethylene with hybrid poplars] » ; Environ Health Perspect. 1998 August; 106(Suppl 4): 1001–1004 (Résumé, anglais) et article complet
- Orchard, B. J., Doucette, W. J., Chard, J. K. and Bugbee, B. (2000), « Uptake of trichloroethylene by hybrid poplar trees grown hydroponically in flow-through plant growth chambers ». Environmental Toxicology and Chemistry, 19: 895–903. doi: 10.1002/etc.5620190416 (Résumé, en anglais, et article complet
- Anderson TA, Guthrie EA, Walton BT. Bioremediation in the rhizosphere: plant roots and associated microbes dean contaminated soil. Environ Sci and Technol 27(13):2630-2636 (1993).
- Anderson TA, Walton BT. 1995. « Comparative fate of 14C trichloroethylene in the root zone of plants from a former solvent disposal site ». Environ Toxicol Chem 14:2041–2047.
- Amaral If Helena; Berg Michael; Brennwald S. Matthias; Hofer Markus; Kipfer Rolf;, «13C/12C Analysis of ultra-trace amounts of volatile organic contaminants in groundwater by vacuum extraction», Environ.Sci.Technol, 2010, 44, 1023-1029
- Zwank L.; Berg M.; Schmidt T.; Haderlain S.;, «Compound-specific Carbon isotope Analysis of volatile organic compounds in the low-microgram per liter range», Anal. Chem. 2003, 75, 5575-5583
Liens externes
Catégories :- Produit chimique toxique
- Cancérogène chimique
- Produit chimique dangereux pour l'environnement
- Chloroalcène
- Solvant
Wikimedia Foundation. 2010.





