- Trichlorométhane
-
Chloroforme
Chloroforme 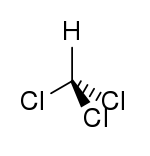
Général Nom IUPAC trichlorométhane No CAS No EINECS PubChem ChEBI SMILES InChI Apparence liquide incolore, volatile, d'odeur caractéristique.[1] Propriétés chimiques Formule brute CHCl3 [Isomères] Masse molaire 119,378 g∙mol-1
C 10,06 %, H 0,84 %, Cl 89,09 %,Propriétés physiques T° fusion -64 °C[1] T° ébullition 62 °C[1] Solubilité 10,62 g/kg d'eau à 0 °C
8,95 g/kg d'eau à 10 °C
8,22 g/kg d'eau à 20 °C
3,81 g/kg d'eau à 25 °CMasse volumique 1.4892 g/mL à 20 °C (liquide)
1.4798 g/mL à 25 °C (liquide)T° d’auto-inflammation ininflammable Point d’éclair aucun Pression de vapeur saturante à 20 °C : 21.2 kPa[1] Viscosité dynamique 0,57 mPa.s à 20 °C Point critique 5,45 MPa
535,6 KConductivité thermique 0,1454 W m-1 K-1 à 20 °C Thermochimie S0gaz, 1 bar 295,61 J mol-1 K-1 ΔfH0gaz -103,18 kJ mol-1 ΔfH0liquide -134,3 kJ mol-1 Cp 114,25 J mol-1 K-1
à 25 °C (liquide)Précautions Directive 67/548/EEC 
XnPhrases R : 22, 38, 40, 48/20/22, Phrases S : 2, 36/37, [2] Transport - 1888 NFPA 704 SIMDUT[4] 
SGH[5] 
AttentionClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[3] Écotoxicologie LogP 1.97[1] Unités du SI & CNTP, sauf indication contraire. Le chloroforme ou trichlorométhane est un composé chimique organochloré possédant la formule brute : CHCl3
Eugène Soubeiran (en France), Justus von Liebig (en Allemagne) et Samuel Guthrie (en Amérique) ont découvert en même temps le chloroforme, préparé pour la première fois en 1831.
Fortement utilisé comme solvant, le chloroforme tend à être remplacé actuellement par le dichlorométhane aux propriétés similaires mais moins toxique. Le chloroforme a été jadis utilisé comme anesthésique dans les blocs opératoires.
Sommaire
Propriétés physico-chimiques
Le chloroforme est un liquide hautement volatil. Toutefois les vapeurs de chloroforme ne forment pas de mélanges explosifs avec l'air.
Le chloroforme est un excellent solvant pour de nombreux matériaux organiques tels que graisses, huiles, résines, cires, etc. Il est complètement miscible avec de nombreux solvants organiques et dissout l'iode et le soufre.
Le chloroforme forme de nombreux mélanges azéotropiques avec d'autres liquides tels que l'acétone, l'éthanol, l'eau et le méthanol.
Le chloroforme a une constante molale cryoscopique de 4,70 °C∙kg/mol et une constante molale ébullioscopique de 3,80 °C∙kg/mol.
Production et synthèse
La production de chloroforme est liée à celle d'autres chlorocarbones. En effet, on produit le chloroforme par chloration successive du méthane ou de l'alcool éthylique.
Un autre procédé utilise le méthanol comme réactif au lieu du méthane. Il s'agit d'un mélange de chloration/hydrochloration qui permet d'éviter la séparation de l'acide chlohydrique du méthane lors du recyclage du réactif non-utilisé.
Il peut être obtenu industriellement par réaction du fer et d'acide sur le tétrachlorométhane.
On peut aussi obtenir du chloroforme plus simplement en traitant l'acétone par le dichlore en présence d'alcalis. Il se forme par l'intermédiaire de la trichloracétone, substance que l'alcali scinde facilement en chloroforme et en sel acétique :
- CH3COCH3 + 3Cl2 + 3KOH → CH3COCCl3 + 3KCl + 3H2O
- CH3COCCl3 + KOH → CH3COOK + CHCl3
Sécurité
Au cours d'un stockage prolongé, en présence d'oxygène et sous l'action de la lumière, le chloroforme a tendance à se décomposer en donnant du chlorure d'hydrogène, du chlore et de l'oxychlorure de carbone (phosgène) qui est un produit extrêmement toxique.
Absorbé ou inhalé à forte concentration, il peut conduire à un coma, voire entraîner des troubles respiratoires et cardiaques qui peuvent s'avérer mortels. Son utilisation en anesthésie a été abandonnée.Composés organochlorés apparentés
Liens externes
- (en) Données physiques
- (fr) INRS Informations toxicologiques
Notes et références
- ↑ a , b , c , d et e CHLOROFORME, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « chloroforme » sur ESIS, consulté le 22 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Chloroforme » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Agents anesthésiques : Anesthésiques volatils Chloroforme • Desflurane • Enflurane • Éther • Halothane • Isoflurane • Méthoxyflurane • Protoxyde d'azote • Sévoflurane • Xénon
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie
Catégories : Produit chimique nocif | Drogue anesthésique | Halogénométhane | Chloroalcane | Gaz halogéné | Hypnotique | Solvant
Wikimedia Foundation. 2010.

