- Pile à combustible
-
Une pile à combustible est une pile où la fabrication de l'électricité se fait grâce à l'oxydation sur une électrode d'un combustible réducteur (par exemple l'hydrogène) couplée à la réduction sur l'autre électrode d'un oxydant, tel que l'oxygène de l'air.
Sommaire
Historique
- 1839 : Découverte de l'effet pile à combustible par l'allemand Christian Schönbein.
- 1839-1842 : Réalisation du premier modèle de laboratoire de pile à combustible par William R. Grove.
- 1932 : Reprise des études au sujet de la pile à combustible par Francis T. Bacon, qui réalise un premier prototype de 1 kW en 1953, puis 5 kW en 1959. Ce prototype servira de modèle pour les futures piles à combustible utilisées lors des missions spatiales Apollo.
- Le très long laps de temps (plus d'un siècle) qui s'est écoulé entre la réalisation du premier modèle de pile à combustible et les premières utilisations s'explique par le très fort développement qu'ont connu les autres types de générateurs d'énergie électrique et par le fait que le coût des matériaux utilisés dans la pile à combustible reste encore actuellement élevé.
En 2007, il semble que les PAC fonctionnant au méthanol destinées à alimenter l'électronique portable seront commercialisées avant celles destinées à l'industrie automobile.
Ce n'est qu'en 2007, sous l'égide du Japon, qu'un début de réflexion sur des normes, règles et standards de fabrication et de sûreté a commencé, de manière à faciliter l'usage généralisé de ces PAC. Le Japon espère ainsi réduire de 50 % ses émissions de CO2 liées à la petite électronique, en proposant par ailleurs des batteries dont l'autonomie sera multipliée par trois[1].
Généralités
 Piscine municipale de Woking. 1ère expérience anglaise de pile à combustible fonctionnant en cogénération (chaleur + électricité pour l'éclairage)
Piscine municipale de Woking. 1ère expérience anglaise de pile à combustible fonctionnant en cogénération (chaleur + électricité pour l'éclairage)
Une pile à combustible est une pile où la fabrication de l'électricité se fait grâce à l'oxydation sur une électrode d'un combustible réducteur (par exemple le dihydrogène) couplée à la réduction sur l'autre électrode d'un oxydant, tel que le dioxygène de l'air. La réaction d'oxydation de l'hydrogène est accélérée par un catalyseur qui est généralement du platine. Si d'autres combinaisons sont possibles, la pile la plus couramment étudiée et utilisée est la pile dihydrogène-dioxygène ou dihydrogène-air.
Perspective :
- Certaines piles (utilisées sur les satellites) contiennent depuis 1977[2] des membranes en polymères (électrolyte solide acide ou alcalin) rendu conducteur, prenant la forme d'une fine membrane séparant les deux électrodes. Ces polymères contiennent du platine (rare, polluant et coûteux ; on lui cherche donc des alternatives, avec en test en Chine un polymère (polysulfone ou quaternary ammonium polysulphone ou QAPS) avec une cathode (côté oxygène) en argent et une anode (côté hydrogène) en nickel plaquée de chrome[3]).
- En 2010, des chercheurs américains et allemands[4] ont proposé d'intégrer un catalyseur supplémentaire, moins coûteux et qui pourrait diviser par deux la quantité de platine des piles à combustibles « Nature Chemistry » [5] ; il s'agit de nanosphères construites avec des atomes de platine et de cuivre, dont les particules de cuivre sont par la suite en partie extraites, laissant une sorte de nanocoquille de platine de quelques atomes d'épaisseur. La méthode de production de ces nanosphères est telle qu'elle diminue leur capacité de fixation de l'oxygène, ce qui favorise la formation d'eau en rendant la pile plus productive. Selon cette équipe cela pourrait réduire de 80 % le prix des piles à combustible. Ce procédé pourrait être appliqué à d'autres métaux pour produire d'autres types de catalyseurs pouvant par exemple permettre une production d'hydrogène et d'oxygène à partir d'eau comme stockage chimique de l'énergie électrique produite par des éoliennes ou des panneaux solaires, avant de la restituer sous forme d'électricité.
Pile à combustible à hydrogène
Le fonctionnement d'une pile dihydrogène-dioxygène est particulièrement propre puisqu'il ne produit que de l'eau et consomme uniquement des gaz. Mais jusqu'en 2010, la fabrication de ces piles est très coûteuse, notamment à cause de la quantité non négligeable de platine nécessaire et au coût des membranes échangeuses d'ions.
Une des difficultés majeures réside dans la synthèse et l'approvisionnement en dihydrogène. Sur Terre, l'hydrogène n'existe en grande quantité que combiné à l'oxygène (H2O, c'est-à-dire l'eau), au soufre (sulfure d'hydrogène, H2S) et au carbone (combustibles fossiles de types gaz naturel ou pétroles). La production de dihydrogène nécessite donc soit d'utiliser des combustibles fossiles, soit de disposer d'énormes quantités d'énergie à faible coût, pour l'obtenir à partir de la décomposition de l'eau, par voie thermique ou électrochimique.
Le dihydrogène peut être comprimé dans des bouteilles à gaz (pression en général de 350 ou 700 bars), ou liquéfié ou combiné chimiquement sous forme de méthanol ou de méthane qui seront ensuite transformés pour libérer du dihydrogène. Les rendements énergétiques cumulés des synthèses du dihydrogène, de compression ou liquéfaction, sont généralement assez faibles. Le dihydrogène n'est donc pas une source d'énergie primaire, c'est un vecteur d'énergie.
Principe de fonctionnement
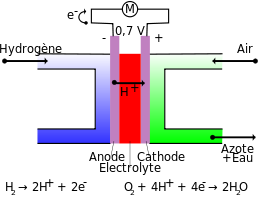
Le principe de la pile à combustible est l'inverse d'une électrolyse. La réaction chimique produite par l'oxydation et la rencontre de gaz produit de l'électricité, de l'eau et de la chaleur. Une pile à combustible produit une tension électrique d'environ 0,7 à 0,8 volt[6], selon la charge (densité de courant) et produit de la chaleur. Leur température de fonctionnement varie de 60 à 200°C selon les modèles. L'eau est généralement évacuée sous forme de vapeur avec l'excédent de dioxygène.
Il existe plusieurs types de piles à combustibles dont les plus connues sont :
- la pile à membrane échangeuse de protons.
- la pile à oxyde solide.
La pile a membrane échangeuse de protons.
Une pile à combustible à membrane échangeuse de protons comporte :
- deux plaques bipolaires :
- une pour distribuer l'hydrogène.
- une autre pour distribuer l'oxygène et évacuer l'eau
- deux électrodes : une anode et une cathode pour faire circuler le courant électrique (électrons).
- une membrane échangeuse de protons faisant fonction d'électrolyte : bloque le passage des électrons et laisse passer les ions H+
- des catalyseurs (platine) : accélèrent les réactions entre les gaz.
L'hydrogène (provenant d'une électrolyse ou d'un reformage d'hydrocarbures) entre par la plaque bipolaire gauche. Arrivé à l'anode, le dihydrogène (H2) se dissocie (oxydation) en protons et en électrons selon : 2H2=4H+ + 4e-. Les protons traversent alors la membrane, mais les électrons, bloqués, sont contraints d'emprunter un circuit extérieur, ce qui va générer un courant électrique.
A la cathode, les protons, les électrons, et du dioxygène (pur ou provenant de l'air) se rencontrent pour former de l'eau selon : 4H+ + 4e- + O2= 2H2O. L'eau et le dioxygène passent par la plaque bipolaire droite. Cette réaction va produire également de la chaleur pouvant être récupérée.
La pile à oxyde solide
Le principe est similaire. La seule différence est que la membrane échangeuse de protons est remplacée par une autre membrane appelée "membrane a oxyde solide". Les molécules dans la pile à combustible ne vont alors pas réagir de la même façon :
- Dans un premier temps, l'hydrogène entre par la plaque bipolaire gauche et arrive sur l'anode.
- Là, l'hydrogène se dissocie (2H2=4H+ + 4e-) (jusque là, aucun changement).
- Les électrons (e-) emprunteront un circuit extérieur, mais les ions H+ (protons), au lieu de traverser la membrane, resteront sur l'électrode.
- Après avoir traversé les dipôles, les électrons rejoignent la cathode chargée en dioxygène. Les deux molécules vont former un assemblage de molécules appelé (O²-).
- Les O- traversent la membrane et se combinent avec les ions pour former de l'eau selon : 4H+ + 4e- + O2= 2H2+ O2= 2H2O
Mais ce type de pile n'est pas plus performant que la pile à membrane échangeuse de protons et sa fabrication coûte plus cher.
Pile à combustible au méthanol
Il existe deux types de piles à combustible au méthanol :
- Les piles RMFC (Reformed Methanol Fuel Cell) : dans ces piles, le méthanol est reformé pour produire l'hydrogène qui alimentera la pile.
- Les piles DMFC (Direct Methanol Fuel Cell) : dans ces piles, le méthanol est directement oxydé dans le cœur de la pile et ne nécessite pas d'être reformé.
Contrairement aux piles utilisant l'hydrogène, celles-ci ne sont pas "propres" car elles rejettent du CO2 et même du monoxyde de carbone (CO).
Tableau récapitulatif des différentes techniques de piles à combustible
Description Électrolyte Ions mis en œuvre Gaz/liquide à l'anode Gaz à la cathode Puissance Température de fonctionnement Rendement électrique Maturité Domaine AFC – Pile à combustible alcaline Hydroxyde de potassium OH– dihydrogène dioxygène 10 à 100 kW 60 °C à 90 °C Stack : 60-70 % Système : 62 % Commercialisé/ Développement Portable, transport DBFC – Pile à combustible à hydrure de bore direct Membrane protonique Membrane anionique
H+ OH–
NaBH4 liquide dioxygène 250mW/cm² 20 °C à 80 °C 50% monocellule Développement portable <20W PEMFC – Pile à combustible à membrane d'échange de protons Membranes polymère Nafion-PBI H+ dihydrogène dioxygène 0,1 à 500 kW 60 °C à 220 °C Stack : 50-70 % Système : 30–50 % Commercialisé/ Développement portable, transport, stationnaire DMFC – Pile à combustible à méthanol direct Membrane polymère H+ méthanol dioxygène mW à 100 kW 90 °C à 120 °C Stack : 20–30 % Commercialisé/ Développement transport, stationnaire DEFC – Pile à combustible à éthanol direct 90 °C à 120 °C Développement FAFC – Pile à combustible à acide formique 90 °C à 120 °C Développement PAFC – Pile à combustible à acide phosphorique Acide phosphorique H+ dihydrogène dioxygène jusqu'à 10 MW environ 200 °C Stack : 55 % Système : 40 % Développement transport, stationnaire MCFC – Pile à combustible à carbonate fondu Carbonate de métaux alcalins CO32– dihydrogène, Méthane, Gaz de synthèse dioxygène jusqu'à 100 MW environ 650 °C Stack : 55 % Système : 47 % Développement/ Mise sur le marché stationnaire PCFC – Pile à combustible à céramique protonante 700 °C Développement SOFC – Pile à combustible à oxyde solide Céramique O2– dihydrogène, Méthane, Gaz de synthèse dioxygène jusqu'à 100 MW 800 °C à 1 050 °C Stack : 60–65 % Système : 55–60 % Développement stationnaire Applications et perspectives
Grâce aux progrès incessants de ces techniques, dont les premiers développements dans le domaine spatial remontent aux années 1960, et à la baisse des prix, son utilisation croît dans de nouveaux domaines. Notamment pour alimenter des prototypes d'ordinateurs portables, de téléphones portables ou d'appareils photographiques ou encore de véhicules propres. On projette de les utiliser pour les véhicules terrestres, mais aussi marins, dont bateaux de pêche (avec en France le pôle PRINA ; Pôle de Recherche et d’Innovation de Nantes-Atlantique et Atlanpole, porteur de la Mission Hydrogène[7] et le projet SHYPER ("Système hydrogène pour une pêche écologiquement responsable[8],Bateau propulsé à l'hydrogène, Ouest-France, 2009/04/06), et un prototype de bateau de loisir fluvial présenté en 2008 au salon nautique, avec aussi des questions à régler d'homologation, de sécurité et d'assurance pour ces véhicules d'un nouveau type.
La viabilité industrielle se heurte encore à un rendement énergétique global assez faible compte tenu du fait que chaque étape (synthèse de l'hydrogène, séchage du gaz, stockage, vaporisation, rendement des réactions électrochimiques de la pile, circulation des fluides, régulation thermique, maintenance, récupération du platine, etc.) contribue à un rendement global encore décevant. En 2009, des chercheurs japonais ont maintenu un rendement de 56 % pendant plusieurs centaines d'heures avec une pile de 3 kW[9]. Dans le cadre du projet HiPer-FC (High Performance Fuel Cell) lancé par la NEDO en 2008, un Centre de Recherche sur les Nanomatériaux pour les Piles à Combustible travaille depuis le 25 août 2009[10]. Les chercheurs (en 2009) y sont japonais mais aussi nord-américains, allemands, français, coréens et chinois.
Le conditionnement solide et stable du dihydrogène sous forme de pastilles aminées est exploré pour un stockage et transport du dihydrogène plus sûr.
La cogénération - en valorisant mieux la production thermique d'une pile - augmente l'intérêt environnemental (bruit, rejets) et technique des piles (si le dihydrogène est produit de manière propre et sûre), mais ces systèmes demeurent encore trop chers pour une utilisation courante.
Programmes de recherche ou de développement
Par zones géographiques
Les États-Unis développent de nombreux projets soutenus par le gouvernement, parfois présentés comme une des solutions majeures contre le réchauffement climatique.
Au Canada, l'Institut d'Innovation en Piles à Combustible du Conseil National de Recherches du Canada (IIPC-CNRC), a été créé en septembre 2006 sur 6 500 m2, en Colombie britannique (UBC), dans la grappe technologique de la région de Vancouver, pilote dans ce domaine.
Il vise à développer l'industrie de l'hydrogène et des piles à combustible au Canada. C’est une plate-forme de démonstration autant que de recherche, qui abrite aussi le Programme de Vancouver sur les véhicules à piles à combustible, ainsi que le projet d’autoroute de l'hydrogène de la Colombie britannique, épaulés par des laboratoires consacrés à l'alimentation en hydrogène et aux techniques de piles à combustible intégrées. Le site dispose de pompes géothermiques et de moyens photovoltaïques de production d'hydrogène.
L'Europe s'est dotée en 2008 d'un cadre (règlement européen) pour le développement des véhicules à hydrogène (comme combustible), mais soutient aussi des projets de recherche sur les piles à hydrogène
En France, l’ADEME, EDF et le CEA ont installé un réseau "PILE A COMBUSTIBLE" le 25 juin 1999 piloté par Catherine Ronge, directrice R&D d'Air liquide et Roger Ballay, directeur adjoint de la recherche à EDF, co-animé par l'ADEME et le Commissariat à l'Énergie Atomique (CEA). Ce réseau avait pour missions d’accélérer les recherches sur la pile à combustible en identifiant les verrous technologiques, d'animer la communauté scientifique autour d’un pôle d'expertise susceptible de valoriser et diffuser les avancées de la recherche, de développer les partenariats public-privé et une réflexion prospective sur le développement de ces techniques.
Depuis 2005, en France, le réseau PACo a été remplacé par le programme PANH (Plan d'action sur l'hydrogène et les piles à combustible) de l'ANR (Agence nationale de la recherche)
Dans le nord de la France, le laboratoire de nanotechnologies de l'Institut d'électronique de microélectronique et de nanotechnologie a réalisé en mai 2009 une pile à combustible de très petites dimensions (5 x 3,6 mm)[11].
Automobile
- BMW :
-
- BMW Hydrogen 7
- N'utilise pas de pile à combustible. Il s'agit d'un moteur à combustion classique utilisant de l'hydrogène comme combustible.
- Daimler :
-
- NECAR et F-Cell'
- Toute une famille de véhicules avec différents types de combustible (hydrogène gazeux, méthanol...). À ce jour (2010) Daimler a construit le plus grand nombre de véhicules utilisant une pile à combustible (plus de 100). Mercedes a annoncé la production en série pour le grand public de la classe B F-Cell Hydrogène en 2015[12].
- Ford :
-
- Focus FCV
-
- Sequel voiture. La pile à hydrogène de 73 kW est alimentée par trois bouteilles à gaz bobinées composite de dihydrogène de 700 bars (2005).
- Chevy Volt: concept présenté en janvier 2007 au salon automobile de Detroit (États-Unis).
- Hydrogen 4 présenté le 6 mars 2008 au 78e Salon International de l’Automobile de Genève (Suisse). La pile à combustible du GM HydroGen4 se compose de 440 cellules connectées en série. L’ensemble du système offre une puissance électrique atteignant 93 kW alimentant un moteur électrique synchrone de 73 kW soit 100 ch. Il permet à l’HydroGen4 de franchir le zéro à 100 km/h en 12 secondes environ. Le HydroGen4 dispose d’un système de stockage comprenant trois réservoirs à haute pression de 700 bars réalisés en fibre de carbone, pouvant contenir 4,2 kg d'hydrogène. Ce qui permet une autonomie atteignant 320 kilomètres[13].
- Honda :
-
- Honda FCX Clarity : première voiture de série, commercialisé (en location) au Japon et aux États-Unis (État de Californie). Véhicule 5 places, équipé d'un réservoir d'une pression de 350 bars.
- Honda CR-X
- Hummer :
-
- Hummer O2 : Concept-car tout-terrain.
- Hyundai :
-
- Tucson FCEV : voiture hybride. La pile à hydrogène de 80 kW est alimentée par une bouteille à gaz bobinée composite.
- Michelin :
-
- prototype de voiture Hy-light fonctionnant avec une pile à hydrogène (présentation en mars 2005). La pile est alimentée par du dihydrogène provenant de trois bouteilles haute pression bobinées composite.
- prototype de voiture Hy-light 2 fonctionnant avec une pile à combustible fabriqué par Michelin même. Elle a été présentée en septembre 2007. Par rapport à la hy-light, la 2e génération possède des batteries et plus des supercapacités.
- PSA :
-
- Projet GENEPAC (2002-2006) mené en collaboration avec le CEA. Pile hydrogène de type PEMFC de 80 kW.
- Le modèle expérimental 207 CC
-
- en 2008 présentation du prototype Renault scénic ZEV H2 à pile à combustible[14] .
- Suzuki (en collaboration avec General Motors) :
-
- Prototype de voiture Mr Wagon FCW'. La pile à hydrogène est alimentée par du dihydrogène contenu dans des réservoirs à 700 bars.
- Toyota :
-
- Voiture cinq places FCHV-4 et bus FCHV-US1. Ces programmes ont été présentés pour la première fois en 2001. Ils comportent une pile à hydrogène de 90 kW.
- Prévu pour 2015, Toyota annonce (juin 2009) le développement de voitures électriques entièrement fondées sur les piles à combustion en vente (contrairement à aujourd'hui où les voitures électriques sont en leasing)[15].
Autres domaines
- Tracteur : Prototype de tracteur fonctionnant à l'hydrogène (New Holland)
- Production électrique stationnaire
- produits de la société américaine Fuel Cell Energy
- Axane (Air liquide) : Evopac, système d'alimentation autonome alimenté par du dihydrogène.
- Système de refroidissement par évaporation inspiré des plantes vertes pour les piles à combustible des ordinateurs portables de demain.
- Aéronautique : Antares DLR-H2 , hydrogen Flying Tour
- Pôle de compétitivité Tenerrdis
Notes et références
- (en) Nikkei Net (29 septembre 2007)
- ex : Nafion de Dupont de Nemours, pour le PEMFC (Proton Exchange Membrane fuel Cell, pile à combustible à membrane échangeuse de protons), ces piles utilisées dans l'Espace
- Shanfu Lu, Jing Pan, Aibin Huang, Lin Zhuang, and Juntao Lu Alkaline polymer electrolyte fuel cells completely free from noble metal catalysts ; Résumé (en anglais) PNAS 2008 105: 20611-20614.
- équipe dirigée par Peter Strasser, de l'Université technique de Berlin et du pôle d'excellence UniCat (Unifying Concepts in Catalysis, cluster allemand visant à améliorer la catalyse, associant 250 chimistes, physiciens, biologistes de 4 universités et 2 Instituts l'Inst. Max-Planck de Berlin et celui du Brandebourg), avec un budget de 7 millions d'euros en 2010)
- Lattice-strain control of the activity in dealloyed core-shell fuel cell catalysts ; Journal Nature
- (en) Comment fonctionne une pile à combustible
- [Vers les bateaux à hydrogène Source ; Revue Pays de la Loire Magazine n° 20 ; juin 2008 ; p9 Date 2008/06/01]
- GAMBERT Philippe ; Bateaux à hydrogène pour la pêche et les rivières ; Ouest-France, Ed Nantes 2008/12/07 P.10
- Brève de l'ambassade de France au Japon / ADIT intitulée « Rendement record pour une nouvelle pile à combustible » (BE Japon 501 du 2009 05 18), d'après une source japonaise
- Centre initié en 2008 par la NEDO, le METI et le département de Yamanashi. Il est basé sur le campus de Kofu de l'Université de Yamanashi, piloté par le Pr. Masahiro WATANABE
- Actualité du site Techno-Sciences.net
- essai de Mercedes-Benz Classe B F-Cell (2011) Challenges - 16 février 2011
- http://www.gmeurope.info/geneva08/downloads/gm/fr/pdf/FR_GM_at_78th_Motor_Show_in_Geneva.pdf
- http://www.renault.com/renault_com/fr/main/50_INOVATION_ET_TECHNOLOGIE/40_Environnement/_Scenic_ZEV_H2/index.aspx
- http://www.e24.fr/entreprises/transport/article103355.ece/Toyota-nouveau-projet-nouveau-patron.html
Voir aussi
Articles connexes
Liens externes
- Dossier sur la pile à combustible sur futura-sciences.com, publié le 24 janvier 2005
Bibliographie
- Benjamin Blunier et Abdellatif Miraoui, 20 Questions sur la pile à combustible, Editions TECHNIP, 2009, 130 p. (ISBN 978-2710809241)
- Benjamin Blunier et Abdellatif Miraoui, Piles à combustible, Principes, modélisation, applications avec exercices et problèmes corrigés, Ellipses, Technosup, 2007, 192 p. (ISBN 978-2-7298-3107-3).
- Méziane Boudellal, "La pile à combustible", Dunod, Technique et ingénierie, 2007, 304p. (ISBN 978-2-1005-0112-0)
- Portail de la chimie
- Portail de l’énergie
- Portail de l’électricité et de l’électronique
- Portail de l’automobile
Wikimedia Foundation. 2010.