- Leucémie lymphoïde chronique
-
Leucémie lymphoïde chronique
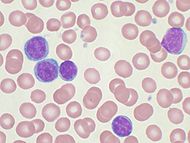
Classification et ressources externesLymphocytes B (cytoplasme bleu et noyau violet) lors d'une leucémie lymphoïde chronique observés sur sang périphérique CIM-10 C91.1 CIM-9 204.1 ICD-O: M9823/3 (CLL)
9670/3 (SCL)DiseasesDB 2641 MedlinePlus 000532 eMedicine med/370 MeSH D015451 La leucémie lymphoïde chronique, ou LLC est une maladie cancéreuse du sang (leucémie), caractérisée par la prolifération de lymphocytes ce qui la place dans la catégorie des hémopathies lymphoïdes chroniques. Il s'agit de la leucémie la plus fréquente, touchant de façon préférentielle les personnes âgées de plus de 50 ans. En dehors de quelques cas familiaux, on ne connaît pas de facteurs favorisant le déclenchement de la maladie qu'ils soient environnementaux, génétiques ou infectieux. Cette affection est incurable à ce jour, mais le pronostic est extrêmement variable d'un malade à l'autre. Pour 60 % des patients il n'est pas nécessaire de débuter un traitement lors du diagnostic initial de la maladie compte tenu de sa lente évolutivité.
Sommaire
Histoire
Les premières recherches sur les leucémies datent du XIXe siècle. La leucémie lymphoïde a été individualisée grâce aux colorations cytologiques d'Ehrlich au sein des leucémies chroniques vers 1880[1].
Physiopathologie et cytologie
La leucémie lymphoïde chronique est définie par la prolifération monoclonale d'une population mature de lymphocytes B (il peut s'agir d'un lymphocyte de type T dans 5 % des cas); ces lymphocytes vont envahir progressivement le sang, les organes lymphoïdes et la moelle osseuse.
Les mécanismes cellulaires induisant la prolifération des lymphocytes sont imparfaitement connus. On estime que les lymphocytes en cause dérivent des couronnes péri-folliculaire des ganglions, que certains réarrangements dans les gènes d'immunoglobulines induisent des lymphocytes de type B, que ce sont les processus de mort programmée cellulaire qui sont perturbés et non la surexpression d'oncogène de multiplication. La dysrégulation semble atteindre une sous-population particulière de lymphocyte B étroitement impliquée dans l'ordonnancement de la reconnaissance et la tolérance du soi. Cette atteinte sélective explique probablement la grande quantité de maladies auto-immunes compliquant la leucémie lymphoïde chronique (voir Complications).
L'étude du réarrangement des gènes d'immunoglobulines montre de nombreuses mutations somatiques ce qui est caractéristique des lymphocytes matures à un stade post-germinal, et non pas de lymphocytes naïfs.
Ces lymphocytes B expriment normalement à leur surface membranaire des protéines antigéniques dites cluster de différentiation (CD) caractéristiques de l'origine B: le CD19 et le CD20+ ainsi que de façon anormale le CD5 (marqueur exprimé normalement par les lymphocytes T) et le CD23+. Les CD5 et CD23 sont parfois présents sur des lymphocytes B lors de leur activation antigénique, mais pas de façon constante; des lymphocytes B CD5+ se voient également chez des patients atteints de maladies autoimmunes. La population leucémique est ainsi CD19+ CD20+ CD5+.
Les lymphocytes B leucémiques expriment avec une faible intensité la même immunoglobuline de membrane à chaîne légère κ ou λ et chaîne lourde de type M parfois de type D ce qui caractérise leur caractère monoclonal (IgG et IgA dans 10% des cas).
Ces cellules lymphocytaires B sont immuno-incompétentes donc incapables de répondre à la stimulation antigénique pour fabriquer des anticorps et défendre l'organisme contre une agression. Ils expriment de façon réduite, en particulier, les récepteurs membranaires qui sont présents en grand nombre sur les lymphocytes B normaux. Ce déficit ne semble pas être dû à un défaut de synthèse mais à une anomalie de repliement empêchant leur expression sur la membrance cellulaire[2].
Ces lymphocytes B monoclonaux présentent de manière fréquente de nombreuses mutations ainsi que des anomalies chromosomiques sans que le rôle exact de ces derniers dans la genèse de la leucémie puisse être établi[3].
L'hypothèse d'une apoptose réduite (mort cellulaire programmée) a été évoquée comme possible cause de la prolifération de lymphocytes matures : l'expression de certains gènes en rapport avec l'inhibition de l'apoptose semble être augmentée dans certains cas[3].
Épidémiologie
Epidémiologie descriptive
En matière de leucémie lymphoïde chronique, le ratio homme/femme est de 2/1 et le pic de fréquence se situe vers l'âge de 65 ans. La LLC est exceptionnelle avant 40 ans, touche un patient de plus de 50 ans dans 90 % des cas et de plus de 60 ans dans 66 %.
C'est la leucémie chronique la plus fréquente dans les pays occidentaux, son incidence est évaluée à 3,5 nouveaux cas pour 100 000 personnes aux États-Unis[4].
Elle est plus rare en extrême-orient[3].
Epidémiologie analytique
Il semble exister une prédisposition familiale avec un risque multiplié par trois si un membre de la fratrie est atteint[5].
Il ne semble pas avoir de facteurs environnementaux déclenchants à l'exception de l'exposition à un défoliant, l'agent orange[3].
De même, le rôle potentialisateur d'une irradiation reste controversé[6].
Des infections répétées, en particulier pulmonaires, semblent cependant représenter un facteur de risque de la maladie, probablement en raison d'une stimulation itérative du système immunitaire[7].
Éléments diagnostiques
Le diagnostic est souvent suspecté sur l'apparition chez un sujet âgé de nombreux ganglions superficiels et accessibles à la palpation (adénopathies). Le plus souvent le diagnostic est suspecté devant une augmentation du nombre de lymphocytes (lymphocytose) à la numération formule sanguine à plus de 4 000/µl, augmentation confirmée sur plusieurs examens.
Présentation clinique
Dans environ un tiers des cas, il n'existe aucun signe clinique de la maladie. Celle-ci est souvent découverte au décours d'une prise de sang (comportant un hémogramme) demandé à titre systématique. La forme clinique la plus fréquente reste la découverte par le patient ou au décours d'un examen d'une adénopathie superficielle ou d'une splénomégalie (rate augmentée de volume). Plus rarement, le diagnostic est porté au détours d'une complication infectieuse ou d'une manifestation auto-immune. La présence d'une fièvre, de sueurs nocturnes ou d'une altération de l'état général doit faire rechercher une infection sous-jacente, une transformation de la LLC en lymphome de haut grade (syndrome de Richter) ou un cancer touchant d'autres organes.
Examens complémentaires
Bilan systématique
Une fois le diagnostic suspecté, le bilan diagnostic comprendra de façon systématique un hémogramme avec frottis sanguin, une étude immunophénotypique des lymphocytes sanguins en cytométrie de flux, un caryotype, une électrophorèse des protéines sériques complétée par une immuno-électrophorèse, plus sensible, un test de Coombs et une radiographie thoracique.
L'immunophénotypage des lymphocytes sanguins est l'examen central du diagnostic. il confirme la présence d'une prolifération monoclonale de lymphocytes B (CD19+ CD20+) coexprimant CD5+, marqueur habituel des lymphocytes T. Le caractère monoclonal est caractérisé par l'expression d'une seule chaîne légère κ ou λ.
L'hémogramme montrera de façon constante un nombre de lymphocytes supérieure à 4 000/µl (lymphocytose). Cette lymphocytose est indispensable au diagnostic. Elle est variable et atteint parfois des valeurs très élevées (> 200 000/µl). L'anémie et la thrombopénie (baisse du nombre de plaquettes sanguines) ne sont pas systématiques et sont caractéristiques de formes plus graves. Les causes de l'anémie et de la thrombopénie sont plurifactorielles: auto-immunité, erythroblastopénie auto immune, splénomégalie, défaut de production médullaire du fait de l'envahissement de la moelle, et inflammation.
Le frottis sanguin montre fréquemment des cellules altérées et des noyaux nus, appelés « ombre de Gümprecht ».
L'électrophorèse des protides retrouve une hypogammaglobulinémie (dans 30 à 60 % des LLC). L'immuno-électrophorèseune peut révéler la présence d'une immunoglobulinémie monoclonale (dans 10% des cas de LLC). Enfin, le test de Coombs peut montrer une auto-immunisation anti-érythrocytaire.
L'examen cytogénétique (caryotype) des cellules de la lignée lymphocytaire n'est pas indispensable au diagnostic mais semble avoir une valeur pronostique importante. Le caryotype retrouve des anomalies chromosomiques dans 50 % à 80 % des cas. Les anomalies les plus fréquemment retrouvées sont une délétion du bras long du chromosome 13 (délétion 13q) et la trisomie du chromosome 12. Certaines anomalies sont de mauvais pronostic comme les délétions des chromosomes 11 et 17 (17q avec perte du gène suppresseur de tumeur p53) de même que des anomalies du bras long du chromosome 11 (11q23).
Bilan optionnel
Depuis le développement de l'immunophénotypage, le myélogramme, nécessitant une ponction de la moelle osseuse, n'est plus indispensable au diagnostic. La biopsie ostéo-médullaire ou ganglionnaire peut être utile dans certains diagnostic difficiles ou lors d'une suspicion de transformation en lymphome de haut grade (syndrome de Richter)
Formes cliniques
- Les lymphomes lymphocytiques ayant un syndrome tumoral au premier plan, prépondérant sur la phase leucémique.
- Les leucémie lymphoïde chronique de phénotype B CD5(-) représentent environ 10 % des LLC.
- Les leucémie lymphoïde chronique de phénotype T représentent environ 5 % des LLC.
Diagnostic différentiel
Les principaux diagnostics différentiels de la leucémie lymphoïde chronique peuvent être les hyperlymphocytoses infectieuses, le lymphome non-Hodgkinien, le lymphome du manteau, la leucémie à prolymphocytes, la leucémie à tricholeucocytes, la maladie de Waldenström.
Dans certains cas, il existe un prolifération monoclonale de lymphocytes mais dont le nombre reste en deçà du seuil duquel on pose le diagnostic de LLC. Cette entité, appelé lymphocytose monoclonale de type B pourrait être une forme pré-leucémique mais cela reste discuté[8].
Histoire naturelle de la maladie
Complications
L'hyperuricémie (augmentation du taux d'acide urique dans le sang) n'est pas rare.
Le syndrome de Richter survient dans 10 % des cas, se caractérisant par un syndrome tumoral lié à l'envahissement de l'organisme par une multiplication de cellules lymphocytaires B pouvant mimer un authentique lymphome malin non-hodgkinien; il s'agit d'un lymphome de type immunoblastique à grandes cellules.
L'insuffisance médullaire peut être consécutive à l'envahissement de la moelle osseuse ce qui vient limiter sa production de cellules sanguines. La diminution de fabrication des globules rouges (érythrocytes) conduit à l'anémie, celle des plaquettes à la thrombopénie et aux syndromes hémorragiques, celle des polynucléaires neutrophiles (granulocytes) favorise les infections bactériennes.
Le déficit d'immunité humoral est en grande partie lié à l'hypogammaglobulinémie qui sera confirmée par un dosage pondéral des IgG, IgM, et IgA. Les infections sont plus fréquentes et touchent la sphère ORL et pulmonaire.
L'auto-immunité qui se développe dans de rare cas peut entraîner des anémies hémolytiques avec test de Coombs direct positif (et baisse de l'haptoglobine).
Pronostic
Le pronostic de la leucémie lymphoïde chronique est extrêmement variable suivant les patients. Des classifications pronostics ont été développées pour adapter le traitement au rythme évolutif de la maladie. Celles les plus fréquemment utilisées sont la classification de Rai_[9] aux États-Unis et la classification de Binet[10] en Europe.
Classification de Binet[10] Stades Pronostic Critères de définition Répartition des LLC en % survie médiane (en mois) Stade A Bon pronostic Lymphocytose, taux d'hémoglobine > 100 g/l et numération des plaquettes > 100 G/l,
moins de trois aires ganglionnaires atteintes63 % > 120 Stade B Pronostic intermédiaire Lymphocytose, taux d'hémoglobine > 100 g/l et numération des plaquettes > 100 G/l,
plus de trois aires ganglionnaires atteintes30 % 70 Stade C Mauvais pronostic Lymphocytose, taux d'hémoglobine < 100 g/l ou numération des plaquettes < 100 G/l,
quel que soit le nombre d'aires lymphoïdes atteintes7 % 40 Les aires lymphoïdes peuvent être les aires cervicales, axillaires, inguinales (qu'elles soient unilatérales ou bilatérales), la rate ou le foie. Ces anomalies étant déterminées par la palpation lors de l'examen clinique.
Cette classification est suffisamment précise pour caractériser les formes graves. En revanche, il est nécessaire de déterminer de nouveaux marqueurs biologiques pour mieux connaître le pronostic des LLC de stade A. Certains paramètres biologiques ont une valeur pronostic péjorative comme :
- un temps de doublement du nombre de lymphocytes circulants inférieur à 12 mois,
- un taux sérique des LDH élevé,
- un taux sérique de β2 microglobulines élevé.
Classification de RAI (publiée en 1975[9]révisée en 1980) Stades Critères de définition Pronostic survie médiane (en mois) Stade 0 Lymphocytose sanguine > 5.109/L et médullaire isolées sans adénopathies ni splénomégalie Bon pronostic > 120 stade I Stade 0 (hyperleucocytose) et adénopathies sans splénomégalie ni hépatomégalie pronostic intermédiaire > 100 Stade II Stade 0 et splénomégalie et/ou adénopathies et/ou hépatomégalie 70 Stade III Stade 0 et anémie (Hb < 11g/dl) qu'il y ait ou non adénopathies ou splénomégalie ou hépatomégalie Mauvais pronostic 24 Stade IV Stade 0 et thrombopénie (Plaq < 100 000/mm3 ) qu'il y ait ou non adénopathies ou splénomégalie ou hépatomégalie Traitement
- Le traitement dépend évidemment du stade de la maladie. Selon la classification de Binet, il n'y a pas d'indication aujourd'hui à traiter les patients au stade A ce qui correspond à 65 % des patients; en revanche, il est nécessaire de traiter les patients de stade B ou C. Le traitement étiologique repose sur la chimiothérapie orale ou injectable. Dans les formes de mauvais pronostic, il peut être proposé un traitement intensif sous la forme d'une chimiothérapie intensive suivie d'une greffe de moelle; il peut s'agir d'une autogreffe (le donneur étant le patient lui-même), ou d'une allogreffe (le donneur étant un membre de sa fratrie un donneur volontaire de moelle).
- Les complications évolutives sont traitées de façon spécifique (cf infra)
Modalités thérapeutiques
Chimiothérapie
Les produits de chimiothérapie utilisés dans le traitement intensif de la leucémie lymphoïde sont le chlorambucil employé seul, la fludarabine employée seule, des cures mensuelles de chimiothérapie de type CHOP (association de quatre agents: Cyclophosphamide-(H)adryamicine-Oncovin(vincristine)-Prednisone).
Thérapie ciblée
Les cellules leucémiques étant CD20+, un anti-CD20 (anticorps monoclonal reconnaissant spécifiquement le CD20) peut être utilisé lors du traitement. Le rituximab (Mabhtera) fait ainsi partie de l'arsenal thérapeutique.
Traitement des complications auto-immunes
Les complications auto-immunes sont traitées avec une corticothérapie générale continue. En deuxième intention l'injection en intra-veineuse d'immunoglobulines permet une amélioration transitoire. La radiothérapie de la rate voire l'ablation chirugicale de cette dernière (splénectomie) sont utiles en dernier recours.
Traitement des complications infectieuses
- Les complications infectieuses d'origine bactérienne sont traitées par des antibiotiques adaptés.
- Les infections itératives liées à un déficit de l'immunité humorale caractérisé par une hypogammaglobulinémie peuvent être prévenues par l'utilisation d'immunoglobulines intraveineuses polyvalentes.
- En cas de lymphopénie CD4, traduisant un déficit de l'immunité cellulaire, un traitement préventif de la pneumocystose par Bactrim est indiqué.
Stratégie thérapeutique
Stade A de Binet
Il existe à l'heure actuelle un consensus pour ne pas traiter les patients atteints de LLC au stade A.
Stade B et C de Binet
Le traitement de référence actuel (gold standard) est l'association fludarabine + endoxan + rituximab
Notes et références
- Quelques éléments d'histoire de l'hématologie biologiqueP. Triadou Annales de biologie clinique Vol 58;1: 19-28,Jan-fév 2000
- Payelle-Brogard B, Dumas G, Magnac C et Als. Abnormal levels of the alpha chain of the CD22 adhesion molecule may account for low CD22 surface expression in chronic lymphocytic leukemia, Leukemia, 2006;20:877-878
- Dighiero G, Hamblin TJ, [371:1017-1029 Chronic lymphocytic leukaemia], Lancet, 2008;371:1017-1029
- National Cancer Institute. SEER cancer statistics review 1975–2001
- Sellick GS, Catovsky D, Houlston RS, Familial chronic lymphocytic leukemia, Semin Oncol, 2006;33:195-201
- Hamblin TJ, Have we been wrong about ionizing radiation and chronic lymphocytic leukemia?, Leuk Res, 2008;32:523-525
- Landgren O, Rapkin JS, Caporaso NE, et als. Respiratory tract infections and subsequent risk of chronic lymphocytic leukemia, Blood, 2007;109:2198-2201
- Marti GE, Rawstron AC, Ghia P, et als. Diagnostic criteria for monoclonal B-cell lymphocytosis, Br J Haematol, 2005;130:325-332
- Clinical Staging of Chronic Lymphocytic Leukemia Rai KR, all Bloodjournal 1975 Aug;46(2):219-34
- A clinical staging system for chronic lymphocytic leukemia: prognostic significance Binet JL et col "Cancer" 1977 Aug;40(2):855-64.
Annexes
Liens externes
Wikimedia Foundation. 2010.