- Laurylsulfate de sodium
-
 Pour les articles homonymes, voir SDS.
Pour les articles homonymes, voir SDS.Laurylsulfate de sodium 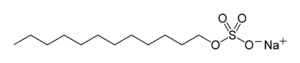
Laurylsulfate de sodium Général Synonymes Dodécylsulfate de sodium No CAS No EINECS No E E487 SMILES Apparence solide de formes variables, blanc, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C12H25NaO4S [Isomères] Masse molaire[2] 288,379 ± 0,018 g·mol-1
C 49,98 %, H 8,74 %, Na 7,97 %, O 22,19 %, S 11,12 %,Propriétés physiques T° fusion 204 à 207 °C[1] Solubilité dans l'eau : 100 g·l-1[1] Masse volumique 1,01 g·cm-3 Précautions SIMDUT[3] 
Unités du SI & CNTP, sauf indication contraire. Le laurylsulfate de sodium ou dodécylsulfate de sodium (SDS) est un détergent et tensioactif ionique fort, couramment utilisé en biochimie et biologie moléculaire.
C'est un composé à ne pas confondre avec le laureth sulfate de sodium.
Sommaire
Généralités
Le dodécylsulfate de sodium (en anglais, Sodium Dodecyl Sulfate ou SDS ou/ NaDS), de formule C12H25NaO4S, aussi connu sous le nom de laurylsulfate de sodium (en anglais, sodium lauryl sulfate ou SLS), est un tensioactif ionique qui est utilisé dans les produits ménagers tels que les dentifrices, shampooings, mousses à raser ou encore bains moussants pour ses effets épaississants et sa capacité à créer une mousse, il est également repris comme additif alimentaire par le codex alimentarius (E487).
La molécule est composée d’une chaîne de 12 atomes de carbone, rattachée à un groupement sulfate conférant à la molécule les propriétés amphiphiles requises pour un détergent. Le SDS est préparé par sulfonation du dodécanol (alcool de lauryl, C12H25OH), suivie par une neutralisation par du carbonate de sodium. Le SDS est utilisé aussi bien dans les procédés industriels que pour les produits cosmétiques destinés au grand public. Comme tous les détergents surfactants (incluant les savons), il enlève l’huile de la peau, et peut causer des irritations de la peau et des yeux. Le SDS peut être converti en laureth sulfate de sodium (également nommé Sodium Lauryl Ether Sulfate ou SLES) par éthoxylation ; ce dernier est moins irritant pour la peau, probablement parce qu’il provoque moins de dénaturation des protéines par rapport à la substance non-éthoxylée (SDS).
C’est probablement le composé surfactant anionique le plus recherché.
En laboratoire, le SDS est communément utilisé afin de préparer des protéines pour réaliser une électrophorèse en gel de polyacrylamide (SDS-PAGE). Le SDS supprime les liaisons non-covalentes de la protéine, permettant la dénaturation de la protéine, la molécule perd donc à terme sa conformation initiale. De plus, les anions du SDS se lient aux peptides à raison d’un anion du SDS tous les deux acides aminés. Cela confère à la protéine une charge globale négative qui est proportionnelle à la masse de la protéine (environ 1,4 g de SDS pour 1 g de protéine). La nouvelle charge négative est significativement plus grande que la charge initiale de cette protéine. La répulsion électrostatique qui est créée par la liaison du SDS cause un déploiement des protéines en une conformation proche d’un triangle, ainsi les différences dues à la conformation de la protéine, apparaissant habituellement au cours de la séparation du gel, sont écartées.
Plus récemment, le SDS a trouvé une application comme surfactant pour les réactions de formation d’hydrates de gaz ou d’hydrates de méthane, augmentant le taux de formation de près de 700 fois[4].
Informations sur les problèmes liés au SDS
Un certain nombre de conditions de sécurité lors de l’utilisation de SDS ont été consignées dans les publications[5],[6],[7]. Elles incluent les recommandations suivantes :
- Le SDS peut causer des affections de la peau (dont le nom général est la dermatite), certaines personnes étant plus affectées que d’autres[7],[8],[9].
- Les recherches toxicologiques effectuées par l'OSHA (Occupational Safety and Health Administration), le NTP (United States Department of Health and Human Services) ainsi que le CIRC (Centre international de recherche sur le cancer) appuient les conclusions de la Cosmetic, Toiletry and Fragrance Association,(CTFA) ainsi que l'American Cancer Society qui déclarent que SLES n'est pas cancérogène[10].
- Bien que le SLES soit légèrement moins irritant que le SDS, il peut se révéler dangereux par le fait qu’il n’est pas métabolisable par le foie[réf. nécessaire].
- Le SDS est connu pour causer des ulcères aphteux ; il est référencé dans certains pays comme « rongeur de plaie »[11],[12]
- Le SDS peut être utilisé en remplacement des SLES moins irritants pour la fabrication de savons, shampooings, lessives, dentifrices et autres produits de bains grâce à son faible coût.
Le laurysulfate de sodium est utilisé comme ingrédient non-médicinal dans l'assemblage de ce médicament : Cymbalta(MC) Médicament pour soulager la dépression et la douleur associé au diabète : Neuropathie périphérique.
Références
- LAURYLSULFATE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Sulfate de dodécyle et de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Kazuyoshi Watanabe, Shuntaro Imai and Yasuhiko H. Mori. Surfactant effects on hydrate formation in an unstirred gas/liquid system: An experimental study using HFC-32 and sodium dodecyl sulfate. Department of Mechanical Engineering, Keio University, 3-14-1 Hiyoshi, Kohoku-ku, Yokohama 223-8522. Japan.Chemical Engineering Science. Volume 60, Issue 17, September 2005, Pages 4846-4857. Résumé
- Agner T. Susceptibility of atopic dermatitis patients to irritant dermatitis caused by sodium lauryl sulphate. Acta Derm Venereol. 1991;71(4):296-300. PMID 1681644]
- A. Nassif, S. C. Chan, F. J. Storrs and J. M. Hanifin. Abstract: Abnormal skin irritancy in atopic dermatitis and in atopy without dermatitis. Arch Dermatol. November 1994;130(11):1402. Résumé
- Marrakchi S, Maibach HI. Sodium lauryl sulfate-induced irritation in the human face: regional and age-related differences. Skin Pharmacol Physiol. 2006;19(3):177-80. Epub 2006 May 4. PMID 16679819
- CIR publication. Final Report on the Safety Assessment of Sodium Lauryl Sulfate and Ammonium Lauryl Sulfate. Journal of the American College of Toxicology. 1983 Vol. 2 (No. 7) pages 127-181.
- Loffler H, Effendy I. Skin susceptibility of atopic individuals. Department of Dermatology, University of Marburg, Germany. Contact Dermatitis. 1999 May;40(5):239-42. PMID 10344477
- Rumor: Sodium Lauryl Sulfate Causes Cancer. The Cosmetic, Toiletry, and Fragrance Association. 13, October 2000. [1]
- Chahine L, Sempson N, Wagoner C. The effect of sodium lauryl sulfate on recurrent aphthous ulcers: a clinical study. Compend Contin Educ Dent. 1997 Dec;18(12):1238-40. PMID 9656847
- Herlofson BB, Barkvoll P. The effect of two toothpaste detergents on the frequency of recurrent aphthous ulcers. Acta Odontol Scand. 1996 Jun;54(3):150-3. PMID 8811135
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium dodecyl sulfate » (voir la liste des auteurs)
Voir aussi
- Liste d'abréviations de biologie cellulaire et moléculaire
Catégories :- Composé du sodium
- Produit chimique domestique
- Cosmétique
- Sulfate
- Tensioactif
Wikimedia Foundation. 2010.
