- Ammonium quaternaire
-
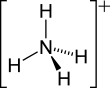
Ammonium
L'ion ammonium (de formule NH4+) est un cation obtenu par protonation de l'ammoniac.
Sommaire
Cas des solutions aqueuses
Dans l'eau, cette réaction s'écrit :
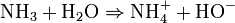 .
.
La réaction est une acido-basique, d'où le couple acide/base suivant : NH4 + / NH3. Dans l'eau, l'ammoniac se dissocie partiellement et forme une solution ionique qui conduit l'électricité. Ce couple a une constante d'acidité Ka = 6,3.10-10 donc pKa = 9,20
Cas général
Dans le cas général, on a :
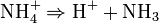 .
.
Il s'agit d'une réaction réversible, qui forme l'acide très faible de Brönsted ammonium. Le taux d'ammonium formé dépend du pH si on travaille en solution. Si on travaille avec de la vapeur d'ammoniac, elle peut réagir avec HCl pour former le complexe
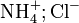 .
.L'ammonium forme souvent un sel avec un anion. La plupart des sels d'ammonium sont solubles dans l'eau.
Voir aussi
- Ammoniac
- Ammoniums quaternaires
Bibliographie
Articles connexes
Liens externes
Notes et références
- Portail de la chimie
Catégories : Cation | Composé de l'ammonium
Wikimedia Foundation. 2010.