- Ion nitrate
-
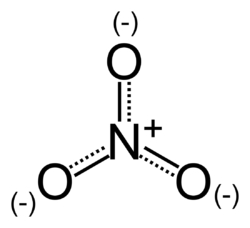
Nitrate
Les nitrates (autrefois nommés nitre, souvent synonyme de salpêtre) sont les sels de l'acide nitrique. La formule chimique de l’ion nitrate est NO3−.
La présence de nitrates dans l'eau est un indice de pollution d'origine agricole (engrais), urbaine (dysfonctionnement des réseaux d'assainissement) ou industrielle. En Europe, la directive Nitrates vise à réduire cette pollution. Dans de nombreux pays, les eaux destinées à la consommation humaine doivent respecter des valeurs limites (par exemple 50 mg/l en France et en Europe) pour être qualifiées de potables. L'OMS recommande de ne pas dépasser 25 mg/l.
Ne pas confondre nitrates et nitrites NO2− sels de l'acide nitreux, ou résultat de la réduction des nitrates par des bactéries spécifiques.
Sommaire
Utilisations
Le nitrate de potassium (salpêtre) est utilisé dans la poudre noire
Les nitrates de sodium (salpêtre du Chili) et d'ammonium sont utilisés comme engrais.
Le nitrate d'ammonium mélangé avec du fioul constitue un explosif puissant. Très stable, il doit être amorcé pour exploser.Pollution de l'eau par les nitrates
Nitrates et eutrophisation
Comme cela a été bien montré dans les lacs[réf. nécessaire] (le lac Valencia par exemple), les phosphates sont le principal facteur d’eutrophisation des eaux douces sur de longs pas de temps. Les nitrates sont la seconde cause importante, et elles interviennent souvent ensemble ; dans les eaux douces, mais aussi dans les eaux saumâtres et salées fermées ou peu renouvelées.
Selon l'Ifremer, au début des années 1900, les taux de nitrates des rivières bretonnes ne devaient pas dépasser 3 à 4 mg/L. Ils ont été multipliés par 10 en moyenne sur un siècle. Selon l'Ifremer toujours, les eutrophisations des baies de Saint-Brieuc, du Mont Saint Michel, de Lannion, Douarnenez ou de la Rade de Brest, constatées depuis la fin du XXe siècle sont typiques des situations de masses d’eau relativement confinées et peu profondes, victimes d’apports récents de nitrates. La biomasse estivale y croît après les apports de nitrate du printemps. Lorsque ces apports diminuent en été, le taux de nitrates dans les ulves diminue également, au point de bloquer la croissance estivale de ces algues alors que le taux de phosphore reste presque stable.
Les modélisations mathématiques d’Ifremer[1] indiquent que diminuer les apports de nitrate agricole est le seul moyen de limiter les pullulations d’ulves au printemps (les taux de nitrates des rivières devant au moins être divisés par quatre, pour passer de 40 mg/L à moins de 10 mg/L), ce qui devrait être possible par des pratiques agricoles adaptées, incluant les réseaux de bandes enherbées protégeant les cours d’eau.
Paradoxalement, une brutale carence en azote d'un milieu aquatique antérieurement eutrophe ou dystrophe peut mener dans un premier temps à des inflorescences de cyanobactéries (ou algues bleues) capable d'assimiler directement l'azote de l'atmosphère et de vivre en condition anaérobie.La mesure la plus adaptée à une lutte contre l'apparition ou le développement des phénomènes d'eutrophisation des eaux douces stagnantes consiste à réduire autant que possible les apports phosphorés. En mer, et dans les baies, les apports en nitrates doivent également faire l'objet d'une réduction.
Toxicité pour les amphibiens
Les concentrations de nitrates requises pour tuer 50 % de têtards de certaines espèces d'amphibiens (études faites en Amérique du Nord) sont de 13 à 40 parties par million (ppm). [2] De faibles concentrations (de 2 à 5 ppm) ont chez certaines espèces d'amphibiens des effets chroniques : nage réduite, malformations au cours du développement[3].
Remarque : 1 ppm équivaut à 1mg par kg, (comparable au mg par litre si la densité de l'eau vaut 1)
Controverse sur la toxicité des nitrates
En 1996, une bibliographie écrite par Jean L'Hirondel et coll.[4], vivement critiquée, tente de faire un résumé des effets bénéfiques supposés des nitrates.
- Effet anti-infectieux
La sécrétion par les glandes salivaires et de la transformation des nitrates salivaires en nitrites permettrait d'utiliser la propriété bactéricide des nitrites, en milieu acide. Celle-ci est connue depuis longtemps dans le secteur agro-alimentaire pour la conservation des aliments. L'effet antibactérien des nitrites acidifiés est vérifié artificiellement pour différentes entérobactéries : salmonelle, escherichia coli, shigella. - Effet sur la tension artérielle et pathologies cardio-vasculaires
L'augmentation des taux sanguins de s-nitrosothiols les apports alimentaires en nitrates principalement constitués des ingestions de légumes et d'eau de boisson pourraient exercer une influence sur les fonctions de l'organisme dépendant du monoxyde d'azote. C'est de cette manière que les nitrates de la nourriture solide et de l'eau de boisson pourraient réduire chez l'homme le risque de pathologie vasculaire cérébrale et d'hypertension artérielle (Bockman et coll., 1997). - Effet sur les cancers gastriques
L'hypothèse de L'hirondel est que les nitrates de l'eau de l'alimentation pourraient jouer un rôle anticarcinogénique. Des travaux complémentaires sont nécessaires pour confirmer ou infirmer cette hypothèse. - Autres
Lors de la synthèse chimique intragastrique du monoxyde d'azote, les apports alimentaires en nitrates joueraient un rôle bénéfique en relaxant la musculature lisse de l'estomac et en protégeant sa muqueuse.
La synthèse bibliographique de Jean L'hirondel a cependant été remise en question par l'association Eau & Rivières l'accusant de se faire le porte-parole des industriels désirant un assouplissement des normes sur les nitrates[5]. Il lui a été reproché d'oublier des références qui dérangeaient sa thèse[6], de s'être abusivement réclamé du soutien du Professeur Hamon[7], d'avoir vu ses thèses réfutées par un rapport de la Section des Eaux du Conseil supérieur d'hygiène publique de France[8] avant même la publication de son livre. Son ouvrage a également été critiqué par la communauté scientifique lors de la Conférence régionale de l'environnement de 1997[9] qui a reproché la légèreté de son étude. L'Institut de l'Environnement qui a financé la publication du livre de Jean L'hirondel, a attaqué l'association Eau & Rivières pour injures publiques et diffamations et a été débouté par le tribunal de Rennes le 3 novembre 1998[10].
Un autre article critiquant la norme qui fixe le seuil acceptable de nitrates dans l’eau de boisson a été publié dans la revue La Recherche [11], extrait d'un ouvrage publié sous la direction de Marian Apfelbaum, professeur de nutrition à la faculté de médecine Xavier-Bichat (Paris). [12]. On peut y lire que « la norme qui fixe le seuil acceptable de nitrates dans l’eau de boisson est [...] le fruit d’une expertise réalisée dans les années 1960, que les nouveaux éléments scientifiques ont démentie ». Il indique également que « La consommation du nitrate est totalement inoffensive chez l’homme. »
Le Peroxyacetylnitrate (PAN) est un des polluants photochimiques de l'air (irritant) qui agit un peu comme l'Ozone, mais en quelque sorte de manière complémentaire. (En zone polluée, et exposées aux UV solaires (ou d'origine artificielle) son taux augmente souvent quand celui de l'ozone diminue)
De nombreuses études mettent en cause un effet toxique des nitrates, en corrélant dans plusieurs pays la mortalité par cancer gastrique avec l'ingestion quotidienne de nitrates.Au-delà d’un certain seuil de concentration, les nitrates peuvent engendrer, chez les enfants et surtout les nourrissons très sensibles à une absorption trop importante, un empoisonnement du sang appelé maladie bleue ou encore méthémoglobinémie. Les nitrates, sous l’action des bactéries présentes dans le corps humain, se transforment en nitrites (NO3--> NO2). Ceux-ci oxydent l’hémoglobine du sang qui ne peut plus fixer l’oxygène ce qui perturbe la respiration cellulaire. Même à faible concentration, ils peuvent également engendrer à long terme des cancers chez les adultes lorsqu’ils sont associés à certains pesticides avec lesquels ils forment des composés cancérigènes.
Références
- ↑ http://www.ifremer.fr/docelec/doc/2003/rapport-143.pdf Rapport Les « marées vertes » en Bretagne, La responsabilité du nitrate ; Rapport interne (Archives publiques d’Ifremer (Juin 2003)
- ↑ La pollution par les nitrates : une menace invisible qui pèse sur les populations d'amphibiens – Service canadien de la faune, Région de l'Ontario
- ↑ La pollution par les nitrates : une menace invisible qui pèse sur les populations d'amphibiens – Service canadien de la faune, Région de l'Ontario
- ↑ Jean L'hirondel et coll., Les nitrates et l'homme : Toxiques, inoffensifs ou bénéfiques ?, 1996, Institut Scientifique et Technique de l'Environnement, ISBN 2-9520087-1-X
- ↑ Actualité des élevages : Les pollueurs avancent masqués
- ↑ Orange
- ↑ Courrier du Pr. Hamon à Christian Buson
- ↑ Conseil supérieur d'hygiène publique de France - Section des Eaux, Présentation et discussion d'un document élaboré par le Dr. L'hirondel sur des normes et des recommandations concernant les nitrates.
- ↑ Conférence Régionale de l'Environnement, lundi 24 mars 1997
- ↑ M. Buson et le lobby nitrates perdent leur procès contre Eau et Rivières
- ↑ Nitrates : une norme aux pieds d’argile, La Recherche, n°339, février 2001
- ↑ Risques et peurs alimentaires, Odile Jacob, ISBN 2-7381-0648-X, novembre 1998
Voir aussi
Liens internes
Liens externes
- Nitrates et pollutions Décembre 2003
- AVIS DU CONSEIL SCIENTIFIQUE Janvier 1994
- Office fédéral de la santé publique
- Portail de la chimie
Catégories : Nitrate | Anion | Métabolisme de l'azote - Effet anti-infectieux
Wikimedia Foundation. 2010.