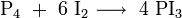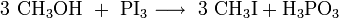- Iodure de méthyle
-
Iodométhane
Iodométhane 
Général Nom IUPAC iodure de méthyle Synonymes Iodure de méthyle No CAS No EINECS SMILES InChI Apparence liquide incolore, d'odeur caractéristique. devient brun lors d'exposition à la lumiere et l'humidite.[1] Propriétés chimiques Formule brute CH3I [Isomères] Masse molaire 141,939 g∙mol-1
C 8,46 %, H 2,13 %, I 89,41 %,Moment dipolaire 1,59 D Propriétés physiques T° fusion -66,5 °C[1] T° ébullition 42,5 °C[1] Solubilité dans l'eau à 20 °C : 1.4 g/100 ml[1] Masse volumique (eau = 1) : 2.3[1] T° d’auto-inflammation 352 °C Limites d’explosivité dans l’air 8.5 - 66% Pression de vapeur saturante à 20 °C : 50 kPa[1],
24.09 psi à 55 °CPropriétés optiques Indice de réfraction 1,5304 (20 °C, D)
1,5293 (21 °C, D)Précautions Directive 67/548/EEC 
TPhrases R : 21, 23/25, 37/38, 40, Phrases S : (1/2), 36/37, 38, 45, Transport - 2644 SIMDUT[3] Produit non classifié SGH[4] 

DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Écotoxicologie LogP 1.51-1.69[1] Unités du SI & CNTP, sauf indication contraire. L'iodométhane, aussi appelé iodure de méthyle, est un composé chimique de formule CH3I, parfois noté MeI. Il s'agit d'un halogénoalcane, dérivé du méthane, où l'un des atomes d'hydrogène a été substitué par un atome d'iode. Il se présente sous la forme d'un liquide incolore, dense, volatile, à l'odeur éthérée, et qui prend un teint violacé exposé à la lumière, du à la présence de diiode I2. L'iodométhane est couramment utilisée en synthèse organique en tant que donneur de groupe méthyle, dans des réactions appelées méthylations. Il est naturellement émis en faible quantité par le riz.[5]
L'iodométhane s'hydrolyse à 270 °C, formant de l'iodure d'hydrogène, de monoxyde de carbone et du dioxyde de carbone.
Sommaire
Synthèse
L'iodométhane peut être synthétisé par une réaction exothermique, par réaction de diiode avec le méthanol en présence de phosphore. Le diidode est alors transformé in situ en triiodure de phosphore. Il s'en suit une substitution nucléophile avec le méthanol[6]:
Une autre méthode est de faire réagir le sulfate de diméthyle avec l'iodure de potassium en présence de carbonate de calcium[6] :
L'iodométhane peut ensuite être obtenu par distillation après lavage au thiosulfate de sodium afin d'éliminer l'excès d'iode.
L'iodométhane peut aussi être produit lors d'accidents nucléaires, par réaction de composés organiques avec de « l'iode de fusion ».
Utilisations
Réactions de méthylation
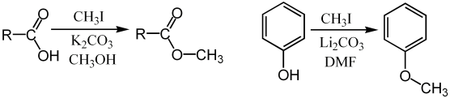
L'iodométhane sert essentiellement pour la méthylation d'autre composés, par des réactions de type SN2. Il peut stériquement facilement être attaqué par des nucléophiles, et l'iodure est un bon nucléofuge.
Il peut par exemple être utilisé pour la méthylation d'acides carboxyliques (transformation en méthanoate de carboxyle) ou de phénols (formation de méthoxybenzènes):
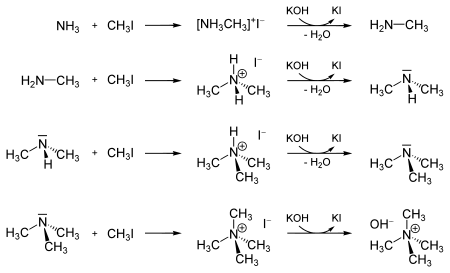
Il peut aussi servir à la méhylation de l'ammoniac et des amines dérivés en iodoammonium. Cette réaction peu se poursuivre, jusqu'à la formation d'un hydroxyde de tétraméthylammonium.
L'iodométhane est aussi un précurseur de l'iodure de méthylmagnesium ou « MeMgI », un organomagnésien souvent utilisé comme réactif. MeMgI se forme assez facilement, il est donc assez souvent utilisé en tant qu'exemple dans l'enseignement de préparation d'organomagnésiens. L'utilisation de MeMgI a cependant été supplantée par l'utilisation de méthyllithium.
Dans le procédé de Monsanto , MeI est formé in situ par la réaction du méthanol et de l'iodure d'hydrogène. Il réagit ensuite avec le monoxyde de carbone en présence de rhodium pour former de l'iodure d'éthanoyle, précurseur de l'acide acétique (obtenu par hydrolyse). Une grande partie de l'acide acétique produit dans le monde l'est par cette méthode.
Autres
Outre son utilisation comme agent de méthylation, certains proposent d'utiliser l'iodométhane comme fongicide, herbicide, insecticide, nématicide ou même dans les extincteurs. Il peut être utilisé comme désinfectant des sols, replaçant le bromométhane (dont l'utilisation a été bannie par la protocole de Montréal), et en microscopie pour ses propriétés liées à son indice de réfraction.
Choix de l'iodomethane comme agent de méthylation
L'iodomethane est un excellent agent de méthylation, mais il y comporte certains inconvénients. Comparé à d'autres halogénométhanes (chlorométhane en particulier) son poids équivalent est plus élevé: une mole de MeI pèse près de trois fois plus que une mole de MeCl. Toutefois, le chlorométhane est un gaz (comme le bromurométhane), ce qui rend leur utilisation plus délicate que l'iodométhane qui est un liquide. Le chlorométhane est un agent de méthylation bien moins fort que MeI, mais il suffit dans la plupart des réactions.
Iodides are generally expensive relative to the more common chlorides and bromides, though iodomethane is reasonably affordable; on a commercial scale the toxic dimethyl sulfate is preferred, since it is both cheap and liquid. Les iodures sont généralement bien plus coûteux que leurs équivalents chlorures ou bromures, mais ce n'est pas le cas de l'iodomethane dont le prix est abordable. À l'échelle commerciale, le sulfate de diméthyle, bien que toxique, est préféré, car il est à la fois bon marché et liquide.
Lors des réactions de substitutions nucléophiles le départ du groupe partant, I- peut entrainer des réaction parasites, car c'est un puissante nucléophile. Enfin, de par sa forte réactivité MeI est plus dangereux pour les personnels le manipulant que ses équivalents bromés et chlorés.
Toxicité et effets biologiques
L'Iodomethane a un LD50 pour les rats de 76 mg/kg (oral), et dans le foie, il est rapidement converti en S-méthylglutathion[7]. L'iodomethane est potentiellement carcérigèneselon les classifcation du CIRC de l'ACGIH, du NTP, et de l'APE. Le CIRC le classe dans le groupe 3 (inclassables quant à leur cancérogénicité pour l'Homme).
L'inhalation de vapeurs d'iodomethane peut provoquer des dommages aux poumons, au foie, aux reins et au système nerveux. Il provoque nausées, étourdissements, toux et vomissements. Un contact prolongé avec la peau provoque des brûlures. Une inhalation massive peut provoquer un œdème pulmonaire.
Notes et références
- ↑ a , b , c , d , e , f et g IODURE DE METHYLE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Iodométhane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone, « Emissions of Methyl Halides and Methane from Rice Paddies », dans Science, vol. 290, 2000, p. 966–969 [lien PMID lien DOI]
- ↑ a et b C. S. King, W. W. Hartman: Methyl Iodide. In: Organic Synthesis, 1943, 2, S. 399 (Article)
- ↑ Johnson, M. K., « Metabolism of iodomethane in the rat », dans Biochem. J., vol. 98, 1966, p. 38–43
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Methyliodid ».
- Portail de la chimie
Catégories : Composé de l'iode | Produit chimique toxique | Halogénométhane | Iodoalcane
Wikimedia Foundation. 2010.