- Hélice alpha
-
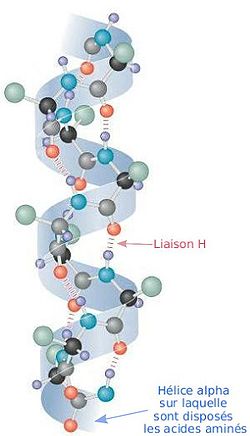
L'hélice alpha est une des deux grandes structures secondaires (avec les feuillets bêta) constituant la structure générale des protéines.
Elle est formée par l'enroulement régulier d'une chaîne polypeptidique sur elle-même.
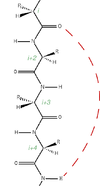
Les atomes d'azote et d'oxygène du squelette protéique sont reliés entre eux par des liaisons hydrogènes parallèles à l'axe de l'hélice, l'acide aminé n étant ainsi relié à l'acide aminé n + 4. Cette structure a été prédite et baptisée hélice alpha par Linus Pauling et ses collaborateurs en 1951[1] sur des considérations théoriques, avant que cela ne soit confirmé quelques années plus tard par la biologie structurale.
Un tour d'hélice correspond à 3,6 résidus (d'acides aminés). Les hélices comprennent au minimum 5 résidus et au maximum 40 résidus. L'angle entre deux plans peptidiques successifs est de 100°, le pas de l'hélice est de 0,54 nm (ou 5,4 Angstrom) et la distance entre deux acides aminés contigus est de 0,15 nm (ou 1,5 Angstrom). L'hélice alpha tourne vers la droite, propriété favorisée par la présence d'acides aminés de la série L. Les chaînes latérales des acides aminés sont à l'extérieur de l'hélice alpha.
Certains acides aminés exercent une influence sur la stabilité de la structure hélicoïdale. La leucine, le tryptophane et la phénylalanine stabilisent l'hélice grâce à des interactions hydrophobes. En revanche, la valine, l'isoleucine, la tyrosine et des résidus diacides et dibasiques voisins la déstabilisent. La présence de proline dans une chaîne polypeptidique entraîne souvent l'interruption de la structure en hélice alpha.
Malgré leur ressemblance avec les hélices alpha, les trois hélices constitutives du collagène sont des hélices d'un type différent, sans liaisons hydrogène intracaténaires (ou intrachaînes). Ces hélices sont des hélices gauches formées par la répulsion des cycles pyrrolidones des nombreux résidus proline de cette molécule.
Articles connexes
Notes et références
- (en) L Pauling, RB Corey et HR Branson, « The structure of proteins : two hydrogen-bonded helical configurations of the polypeptide chain », dans Proc. Natl. Acad. Sci. USA, vol. 37, 1951, p. 205-211 [lien PMID]
Wikimedia Foundation. 2010.