- Hélice Alpha
-
Hélice alpha
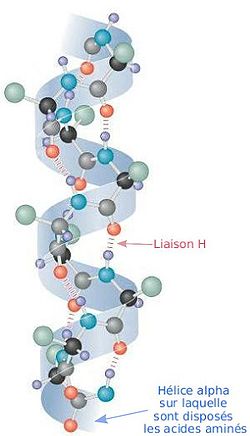
L'hélice alpha est une des deux grandes structures secondaires (avec les feuillets bêta) constituant la structure générale des protéines.
Elle est formée par l'enroulement régulier d'une chaîne polypeptidique sur elle-même.
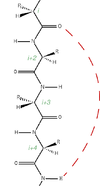
Les atomes d'azote et d'oxygène du squelette protéique sont reliés entre eux par des liaisons hydrogènes parallèles à l'axe de l'hélice, l'acide aminé n étant ainsi relié à l'acide aminé n + 4.
Un tour d'hélice correspond à 3,6 résidus (d'acides aminés). Les hélices comprennent au minimum 5 résidus et au maximum 40 résidus.
Certains acides aminés exercent une influence sur la stabilité de la structure hélicoïdale. La leucine, le tryptophane et la phénylalanine stabilisent l'hélice. En revanche, la valine, l'isoleucine, la tyrosine et des résidus diacides et dibasiques voisins la déstabilisent. La présence de proline dans une chaîne polypeptidique entraîne souvent l'interruption de la structure en hélice alpha.
Malgré leur ressemblance avec les hélices alpha, les trois hélices constitutives du collagène sont des hélices d'un type différent, sans liaisons hydrogène intracaténaires. Ces hélices sont des hélices gauches formées par la répulsion des cycles pyrrolidones des nombreux résidus proline de cette molécule.
- Portail de la biochimie
Catégorie : Protéine
Wikimedia Foundation. 2010.