- Biologie structurale
-
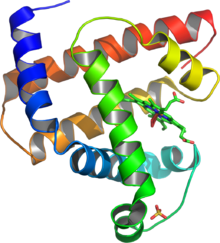 Structure 3D de la myoglobine, la première protéine dont la structure a été résolue par cristallographie par John Kendrew en 1958[1].
Structure 3D de la myoglobine, la première protéine dont la structure a été résolue par cristallographie par John Kendrew en 1958[1].
La biologie structurale est la branche de la biologie qui étudie la structure et l'organisation spatiale des macromolécules biologiques, principalement les protéines et les acides nucléiques. La biologie structurale concerne en particulier la détermination à l'échelle atomique de la structure 3D au moyen de techniques biophysiques, les principes à la base des modifications de conformation des macromolécules, l'analyse des mouvements moléculaires et la dynamique de ces structures.
Les données issues de la biologie structurale sont fréquemment utilisées dans les projets de développement de médicaments. En effet, la compréhension moléculaire et structurale du mode d'action d'un médicament sur sa cible, visualisée par ces approches, permet de rationaliser la conception et l'amélioration de molécules actives. On utilise pour cela à la fois des méthodes expérimentales d'analyse structurale et des approches computationnelles pour prédire des candidats médicaments à partir de la structure.
Sommaire
Techniques de biologie structurale
Les techniques de microscopie optique ne disposent pas de la résolution suffisante pour distinguer les détails des molécules biologique au niveau atomique. Les outils de la biologie structurale sont le plus souvent des méthodes physiques indirectes. La principale méthode est la cristallographie aux rayons X, historiquement la plus ancienne et toujours la plus utilisée. Elle est complétée par la résonance magnétique nucléaire, qui permet aussi d'atteindre la résolution atomique. Il existe aussi des techniques à plus basse résolution, comme la cryomicroscopie électronique et la diffusion aux petits angles.
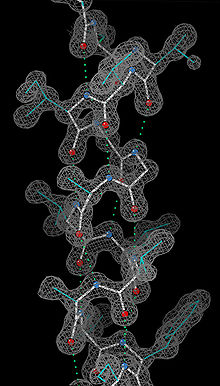
Cristallographie des macromolécules
Article connexe : Diffractométrie de rayons X.La résolution de la structure cristallographique est basée sur l'étude de la diffraction des rayons X par des cristaux de macromolécules. Les rayons X sont diffractés par les électrons et l'analyse permet de remonter à la densité électronique de la molécule, c'est-à-dire la localisation des électrons qui gravitent autour d'elle. Cette densité, pourvu qu'elle soit suffisamment précise, permet de remonter à la localisation de chaque atome de la molécule et donc à ses coordonnées cartésiennes.
Le pré-requis obligatoire pour ce type d'étude est l'obtention de cristaux. Dans des conditions physico-chimiques appropriées (pH, tampon, ions...), les macromolécules en solution peuvent en effet former des cristaux contenant plus ou moins de solvant aqueux. La recherche de ces conditions physico-chimiques favorables est largement empirique, et variable d'une molécule à l'autre. Le degré de pureté de la molécule est également un facteur déterminant. Cette étape de cristallisation est donc souvent limitante dans ce type d'analyse.
Une fois des cristaux de taille suffisante obtenus (quelques dizaines à quelques centaines de microns), on les place dans un faisceau de rayons X monochromatiques, produit par une source adaptée, un générateur de laboratoire ou un synchrotron, ces derniers produisant des faisceaux nettement plus intenses. Dans ces conditions, les électrons des molécules ordonnées dans le cristal diffractent les rayons X. Avec un détecteur, on enregistre des images du motif de diffraction obtenu qui est constitué de taches régulièrement espacées, pour différentes orientations du cristal. L'espacement des tâches renseigne sur la maille du cristal, c'est-à-dire les dimensions de l'élément de volume qui est régulièrement répété dans l'espace, pour donner naissance au cristal. Les intensités des tâches contiennent quant à elles une partie de l'information sur la densité électronique de chacune des macromolécules présentes dans la maille. La phase du signal associé à chaque tache est cependant perdue et il faut alors la reconstituer. Différentes méthodes permettent de reconstruire les phases :
- Le remplacement isomorphe multiple, qui consiste à faire diffuser des atomes lourds (riches en électrons) dans le cristal et à comparer la diffraction avec et sans ces éléments lourds. La présence de l'élément lourd modifie légèrement les intensités de diffraction, ce qui permet de calculer les phases par triangulation, pourvu que l'on puisse positionner les atomes lourds dans la maille du cristal ;
- La diffusion anomale, qui consiste à faire varier la longueur des rayons X autour du seuil d'absorption d'un des types d'atomes contenu dans la molécule. Le sélénium est fréquemment utilisé car il possède un seuil d'absorption X proche des longueurs d'ondes utilisées (autour de 0,1 nm). Pour les protéines, on introduit en général des acides aminés séléniés : sélénocystéine ou sélénométhionine par voie biosynthétique ;
- Le remplacement moléculaire, qui est une méthode utilisant la structure d'une protéine homologue lorsque celle-ci est connue. On essaye de placer la structure homologue dans la maille du cristal et on calcule la diffraction théorique que l'on compare à celle qui est observée. Ceci permet de calculer des phases théoriques initiales ;
Une fois les phases reconstruites, on peut remonter à la densité électronique par transformation de Fourier des signaux de diffraction. On peut alors reconstruire la molécule dans la densité électronique en utilisant des systèmes automatiques ou des logiciels graphiques interactifs, ce qui permet d'obtenir les coordonnées cartésiennes de chaque atome de la molécule. À partir du modèle construit, on peut calculer des intensités de diffraction que l'on compare aux intensités mesurées expérimentalement, ce qui permet d'améliorer progressivement le modèle, une étape appelée "affinement".
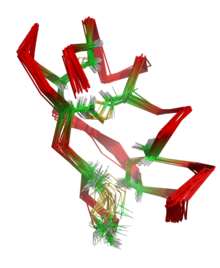
RMN des macromolécules
Article connexe : Résonance magnétique nucléaire.La résonance magnétique nucléaire ou RMN utilise les propriétés magnétiques des noyaux des atomes pour obtenir des informations géométriques (distances, angles...) sur la molécule. À partir de ces informations géométriques, il est ensuite possible d'en reconstruire par le calcul une structure 3D, par une sorte de triangulation.
Les noyaux de certains atomes possèdent un spin nucléaire, en particulier l'hydrogène 1H, le carbone 13C et l'azote 15N. A ce spin est associé un moment dipolaire magnétique. Placés dans un champ magnétique très intense (typiquement 10 à 20 tesla), ces spins s'alignent avec le champ. La RMN étudie les interactions entre spins dans une molécule et permet d'observer principalement deux types d'effets :
- Les interactions scalaires, qui sont des couplages médiés par les électrons de liaison. Ces interactions scalaires permettent d'identifier les connexions à travers les liaisons covalentes de la molécule et donc d'en reconstruire ou d'en identifier la topologie. Elles dépendent de la géométrie des liaisons et en particulier des angles dièdres entre les atomes ;
- Les interactions dipolaires qui correspondent à un transfert d'aimantation à travers l'espace, appelé effet Overhauser nucléaire. Ces interactions dipôle magnétique-dipôle magnétique ne dépendent que de la distance entre les atomes et pas de la géométrie des liaisons et sont observables jusqu'à environ 0,5 nm ;
Un projet de RMN biologique structurale va utiliser un échantillon en solution de la macromolécule et enregistrer des spectres contenant des corrélations des deux types ci-dessus (scalaires et dipolaires). À partir de ces spectres, on va réaliser l'analyse des différents signaux, qui vont être individuellement attribués à chaque atome de la molécule. Cette phase s'appelle l'attribution spectrale. Ensuite, on va collecter un ensemble de données géométriques sur la molécule (distances inter-atomiques, angles dièdres...), appelées contraintes. À partir de ces informations géométriques locales, on va reconstruire par le calcul une structure 3D compatible avec ces contraintes : la structure RMN en solution[2]. Pour cela, on part d'une conformation aléatoire de la molécule, à laquelle on ajoute progressivement les contraintes pour induire son repliement, à l'aide des contraintes. Ce processus est répété à partir de plusieurs conformations initiales différentes, afin de vérifier que le calcul converge vers une solution unique. Pour cette raison, les structures RMN de macromolécules sont en général constituées d'un ensemble de conformations proches.
Cryomicroscopie électronique
 Image brute en cryomicroscopie électronique. Le champ contient des images de la chaperonine GroEL vue sous différentes orientations
Image brute en cryomicroscopie électronique. Le champ contient des images de la chaperonine GroEL vue sous différentes orientations Article connexe : microscopie électronique.
Article connexe : microscopie électronique.La cryomicroscopie électronique permet de reconstituer la structure à basse résolution de complexes macromoléculaires. Un échantillon en solution de l'objet à étudier est soumis à une congélation "flash", par plongement rapide dans un liquide cryogénique (azote liquide). Dans ces conditions, l'eau constituant le solvant forme de la glace amorphe, qui préserve la forme des macromolécules qu'elle contient.
On réalise alors un cliché de microscopie électronique à transmission, dans lequel vont figurer un grand nombre d'images de la molécule d'intérêt, vue sous les différentes orientations dans laquelle elle a été prise dans la glace. Au moyen d'outils informatiques, on va repérer et classifier ces différentes images, afin de regrouper celles qui se ressemblent et correspondent à une vue de l'objet biologique étudié sous une orientation donnée. Sur chacune de ces classes, on va ensuite effectuer des opérations de sommation/moyenne des images ainsi que de filtrage du bruit de fond, pour améliorer le rapport signal sur bruit.
A l'issue de ce traitement, on obtient une série de vues 2D précises de la molécule, qui correspondent à des projections de sa structure 3D. A nouveau au moyen d'outils informatiques, on va reconstruire une enveloppe moléculaire en trois dimensions à partir de ces différentes images 2D. Plusieurs milliers d'images individuelles sont en général nécessaires pour obtenir une reconstruction précise, qui permettra d'avoir une surface d'enveloppe de l'objet, plus ou moins détaillée. Typiquement, pour des édifices non-symétrique, la précision de ces reconstructions est de l'ordre de 1 à 2 nanomètres, parfois subnanométrique pour les systèmes les mieux définis.
Dans le cas d'objets qui sont des oligomères symétriques, comme des capsides de virus, on va de plus utiliser l'information de symétrie intrinsèque de l'objet pour améliorer la précision de sa reconstruction, en imposant cette symétrie lors de la reconstruction de l'enveloppe moléculaire.
Méthodes de diffusion
Article connexe : Diffusion des rayons X aux petits angles.Les méthodes de diffusion au petits angles sont des techniques permettant d'obtenir des informations sur la taille et la forme d'objets contenus dans une solution. En biologie, elle permet d'obtenir des informations à basse résolution sur l'état d'oligomérisation et la forme des macromolécules biologiques. Deux principales techniques de diffusions aux petits angles sont utilisées en biologie structurale : la diffusions des rayons X (SAXS : small angle X-ray scattering) et la diffusions des neutrons (SANS : small angle neutron scattering').
Le principe de ces expériences est simple : une solution concentrée de la macromolécule à étudier est placée dans un faisceau parallèle de rayons X ou de neutrons. Les objets de la solution diffusent le rayonnement incident. Dans le cas des rayons X, la diffusion résulte de l'interaction entre le nuage électronique et les photons. Dans le cas des neutrons, la diffusion résulte de l'interaction avec le noyau des atomes de l'objet en solution. On collecte l'intensité du signal diffusé en fonction de l'angle par rapport au faisceau incident. Ce signal, qui résulte d'une moyenne sur toutes les orientations de la molécule étudiée, donne une information sur sa taille et sa forme ou "enveloppe". En fonction de l'échantillon, les techniques de diffusion permettent des reconstruction avec des précisions pouvant atteindre 1 nm de résolution, en particulier pour des objets possédant des symétries internes.
Modélisation moléculaire
La modélisation moléculaire est un ensemble de méthodes à la frontière de la biologie structurale et de la bio-informatique. Elle consiste à effectuer des calculs informatiques pour reconstruire les structures, effectuer des prédictions structurales ou analyser des propriétés dynamiques de macromolécules. Elle repose souvent sur l'utilisation d'une description des forces moléculaires qui agissent sur les atomes pour simuler des mouvements ou trouver des conformations d'énergie minimale.
Base de données
L'essentiel des données sur les structures des macromolécules biologiques sont aujourd'hui déposées sur une base de données publique, la Protein Data Bank ou PDB. La PDB contient, sous un format standardisé, les données structurales sur les coordonnées des atomes de plus de 70 000 macromolécules ou complexes (chiffres de mai 2011). Ces données sont accessibles librement en ligne (voir liens externes) et les structures peuvent être visualisées au moyen de divers outils logiciels interactifs, dont un grand nombre sont gratuits pour un usage académique.
Les structures PDB sont identifiées par un code unique à 4 lettres ou chiffres, dont le premier est en général un chiffre (exemple : l'identifiant PDB de la structure de myosine illustrant l'introduction de cet article est 2NRL). La PDB recueille la majorité des structures publiées dans la littérature scientifique, le dépôt à la PDB constituant un pré-requis pour l'acceptation d'une publication par la plupart des journaux scientifiques.
Applications de la biologie structurale
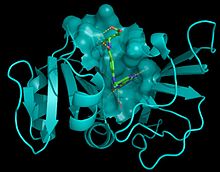 Structure du méthotrexate, un anticancéreux (en vert), complexée à sa cible, la dihydrofolate réductase (en bleu). Cette structure, la première structure d'un complexe médicament-cible, permet de comprendre le mode d'action de la drogue[3].
Structure du méthotrexate, un anticancéreux (en vert), complexée à sa cible, la dihydrofolate réductase (en bleu). Cette structure, la première structure d'un complexe médicament-cible, permet de comprendre le mode d'action de la drogue[3].
La biologie structurale à des applications importantes dans le domaine de la biochimie et de l'enzymologie, pour la compréhension des mécanismes catalytiques et de la reconnaissance spécifique des substrats. L'une des plus importantes applications de la biologie structurale concerne la conception rationnelle de médicaments où la structure tridimensionnelle de la cible (enzyme, récepteur) et est utilisée pour aider à concevoir les ligands. Dans certains cas, on peut résoudre la structure de la cible en complexe avec un ou des ligands fixés, ce qui permet de comprendre les bases moléculaires de la reconnaissance et utiliser cette information pour en améliorer ou en modifier les propriétés (affinité, activité, sélectivité...).
Notes et références
- (en) J.C. Kendrew, G. Bodo, H.M. Dintzis, R.G. Parrish, H. Wyckoff et D.C. Phillipps, « A three-dimensional model of the myoglobin molecule obtained by x-ray analysis », dans Nature, vol. 181, 1958, p. 662-666 [lien PMID]
- Frédéric Dardel et Thérèse Maillavin, « Structure des protéines par RMN », dans Techniques de l'ingénieur, vol. TI053, 2002, p. AF6608 [texte intégral]
- (en) D.A. Matthews, R.A. Alden, J.T. Bolin, S.T. Freer, R. Hamlin, N. Xuong, J. Kraut, M. Poe, M. Williams et K. Hoogsteen, « Dihydrofolate reductase: x-ray structure of the binary complex with methotrexate. », dans Science, vol. 197, 1977, p. 452-455 [lien PMID, lien DOI]
Voir aussi
Bibliographie
- (fr)J. Janin & M. Delepierre (1997) Biologie structurale : Principes et méthodes biophysiques, Hermann, Paris, ISBN 978-2705662325
- (en)C. Branden & J. Tooze (1998) Introduction to Protein Structure, Garland Science, ISBN 978-0815323051
Articles connexes
Liens externes
- Protein Data Bank, base de donnée internationale de biologie structurale
- Proteopedia, wiki permettant une visualisation interactive des structures de la PDB
- Portail de la biologie cellulaire et moléculaire
Catégories :- Biologie moléculaire
- Discipline de la biologie
Wikimedia Foundation. 2010.